
Wetenschap
Wat gebeurt er wanneer zoutzuur reageert met natriumhydroxide?
De chemische vergelijking:
HCl (aq) + NaOH (aq) → NaCl (aq) + h₂o (l)
Verklaring:
* reactanten:
* zoutzuur (HCl) is een sterk zuur, wat betekent dat het gemakkelijk waterstofionen (H⁺) in oplossing doneert.
* Natriumhydroxide (NaOH) is een sterke basis, wat betekent dat het gemakkelijk waterstofionen (H⁺) in oplossing accepteert en hydroxide -ionen (OH⁻) biedt.
* Producten:
* natriumchloride (NaCl) is een zout, gevormd door de combinatie van het natriumkation (Na⁺) van NaOH en de chloride -anion (CL⁻) van HCl. Het lost op in water.
* water (h₂o) wordt gevormd door de combinatie van waterstofionen (H⁺) van HCL en hydroxide -ionen (OH⁻) van NaOH.
Wat gebeurt er in oplossing:
1. ionisatie: HCL en NaOH dissociëren volledig in water, die ionen vormen:
* HCl → H⁺ + Cl⁻
* NaOH → Na⁺ + OH⁻
2. Neutralisatie: De waterstofionen (H⁺) van het zuur reageren met de hydroxide -ionen (OH⁻) van de basis om water te vormen (H₂o):
* H⁺ + oh⁻ → h₂o
3. Zoutvorming: De resterende ionen, natrium (Na⁺) en chloride (CL⁻), combineren om natriumchloride (NaCl) te vormen, die oplost in water.
Belangrijkste kenmerken van de reactie:
* exotherme: De reactie geeft warmte vrij, waardoor de oplossing warmer wordt.
* neutralisatie: De reactie neutraliseert de zure en basiseigenschappen van de reactanten, wat resulteert in een oplossing die dichter bij neutrale pH ligt.
* zoutvorming: De reactie produceert een zout, een verbinding gevormd door de reactie van een zuur en een basis.
Praktische toepassingen:
Deze reactie wordt gebruikt in:
* chemische analyse: Om de concentratie zuren of basen te bepalen.
* Industriële processen: Om de pH van oplossingen aan te passen.
* dagelijks leven: Bij de productie van zeep en wasmiddelen.
 Cijfers leggen uit hoe en waarom West bakt en brandt uitdroogt
Cijfers leggen uit hoe en waarom West bakt en brandt uitdroogt  Waar de octetregel aan is voldaan als twee atomen hoeveel valentie -elektronen verwerven?
Waar de octetregel aan is voldaan als twee atomen hoeveel valentie -elektronen verwerven?  Wat is een atmosferisch gas dat aanzienlijk in concentratie varieert van één locatie tot?
Wat is een atmosferisch gas dat aanzienlijk in concentratie varieert van één locatie tot?  Nieuwe chemie maakt verbeteringen aan magische medicijnen gemakkelijker
Nieuwe chemie maakt verbeteringen aan magische medicijnen gemakkelijker Het blootleggen van ultrasnelle dynamiek van plantenenzymen kan de graanproductie, de medische en farmaceutische industrie vooruit helpen
Het blootleggen van ultrasnelle dynamiek van plantenenzymen kan de graanproductie, de medische en farmaceutische industrie vooruit helpen
Hoofdlijnen
- Hoe drie hardnekkige riffen kunnen helpen de mondiale oesterpopulaties te herstellen
- Wat doen rode bloedcellen in de hersenen?
- Waarom wiebelen planten? Nieuw onderzoek biedt antwoorden
- Wat is controle in wetenschappelijke termen?
- Uit welk type plant komt een touw?
- Onbeleefdheid op het werk:wordt het 'koninginbijensyndroom' erger?
- In sommige delen van de VS daalt het aantal wilde kalkoenen; de belangrijkste reden kan het verlies van leefgebied zijn
- Welk orgaansysteem levert zuurstof en voedingsstoffen aan spierorganen rond het lichaam?
- Welke neuronprocessen die normaal gesproken inkomende stimuli ontvangen, worden opgeroepen?
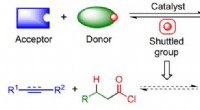
- Voorlopers van zuurchloride maken met behulp van shuttle-katalyse
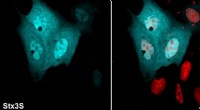
- Beoordeling van de overleving in de lucht van bacteriën in aerosoldruppels van hoesten en niezen

- Koffie-ringeffect aangewend voor snelle, goedkope analyse van kraanwater

- Klasse van eiwitten die betrokken zijn bij essentiële celfuncties heeft een onverwachte rol, wetenschappers ontdekken
- MOF @ holle mesoporeuze koolstofbollen als bifunctionele elektrokatalysatoren
 Hoe autopsies werken
Hoe autopsies werken  Waarom is Emerald een Sillacate Mineral?
Waarom is Emerald een Sillacate Mineral?  In dating-apps, stelt het vrouwen echt in staat hen te dwingen de eerste stap te zetten?
In dating-apps, stelt het vrouwen echt in staat hen te dwingen de eerste stap te zetten? Koolstofafvangproces produceert waterstof en bouwmaterialen
Koolstofafvangproces produceert waterstof en bouwmaterialen Als zuiveringszout reageert met azijn en een gas vormt, is dat dan chemisch of fysisch?
Als zuiveringszout reageert met azijn en een gas vormt, is dat dan chemisch of fysisch?  0,7 oz Hoeveel ml?
0,7 oz Hoeveel ml?  Ransomware-aanval op schapenboeren laat zien dat er geen ruimte is voor wollig denken in cyberbeveiliging
Ransomware-aanval op schapenboeren laat zien dat er geen ruimte is voor wollig denken in cyberbeveiliging Astronomen ontdekken 21 actieve galactische kernen die van uiterlijk veranderen
Astronomen ontdekken 21 actieve galactische kernen die van uiterlijk veranderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

