
Wetenschap
Als ik 50 gram zout oplost in 1000 ml water en de temperatuur daalt van 30,5 graden tot 35,6 Wat is de enthalpie -reactie van warmteverandering een exotherme of endotherm?
Dit is waarom:
* Het oplossen van zout (NaCl) in water is meestal een endotherme proces. Dit betekent dat warmte wordt geabsorbeerd uit de omgeving, waardoor de temperatuur van de oplossing daalt.
* Temperatuur kan niet dalen en vervolgens tegelijkertijd stijgen. Als de temperatuur daalde van 30,5 ° C, kon deze niet stijgen tot 35,6 ° C binnen hetzelfde proces.
Om de enthalpieverandering (AH) van de reactie te berekenen, hebben we de juiste temperatuurverandering nodig.
Hier is hoe we de berekening zouden benaderen als we de juiste temperatuurgegevens hadden:
1. Bereken de temperatuurverandering (AT): Δt =eindtemperatuur - initiële temperatuur
2. Bepaal de massa van de oplossing: Omdat de dichtheid van water ongeveer 1 g/ml is, is de massa van 1000 ml water 1000 g. Voeg de massa van het zout (50 g) toe om de totale massa van de oplossing (1050 g) te krijgen.
3. Gebruik de specifieke warmtecapaciteit van water: De specifieke warmtecapaciteit van water is ongeveer 4.184 J/g ° C.
4. Bereken de warmteverandering (Q): q =massa oplossing × specifieke warmtecapaciteit × Δt
5. Verbind warmteverandering aan enthalpieverandering: Aangezien het proces constant druk is, is de warmteverandering (Q) gelijk aan de enthalpieverandering (AH) van de reactie.
Onthoud: Als de eindtemperatuur lager is dan de initiële temperatuur, zal de enthalpieverandering (AH) positief zijn, wat een endotherme reactie aangeeft. Als de eindtemperatuur hoger is, zal de enthalpieverandering negatief zijn, wat een exotherme reactie aangeeft.
 Akoestische focussering om microplastics in water te verzamelen
Akoestische focussering om microplastics in water te verzamelen Wat is de H3O Plus -concentratie in een oplossing die 100 keer minder zuur is dan één met pH van 3,22?
Wat is de H3O Plus -concentratie in een oplossing die 100 keer minder zuur is dan één met pH van 3,22?  Eenvoudig en leuk chemische reactie-experimenten
Eenvoudig en leuk chemische reactie-experimenten  Waar wordt Rattex van gemaakt?
Waar wordt Rattex van gemaakt?  Hoeveel nitraationen zitten er in een zoutmonster dat 2 mol Ca NO32 · 4H2O bevat?
Hoeveel nitraationen zitten er in een zoutmonster dat 2 mol Ca NO32 · 4H2O bevat?
 Was de aardbeving van Cascadias 1700 onderdeel van een reeks aardbevingen?
Was de aardbeving van Cascadias 1700 onderdeel van een reeks aardbevingen? Ogen in de lucht:hoe satellieten de gezondheid van de infrastructuur kunnen bewaken
Ogen in de lucht:hoe satellieten de gezondheid van de infrastructuur kunnen bewaken Uitputting van hulpbronnen is een ernstig probleem, maar schattingen van de voetafdruk vertellen ons er niet veel over
Uitputting van hulpbronnen is een ernstig probleem, maar schattingen van de voetafdruk vertellen ons er niet veel over Satelliet ziet tropische cycloon Luban naderen Oman
Satelliet ziet tropische cycloon Luban naderen Oman Extreem gevaarlijke orkaan Eta treft Nicaragua
Extreem gevaarlijke orkaan Eta treft Nicaragua
Hoofdlijnen
- De immuunbeschermende eigenschappen van sperma kunnen een link vormen naar de manier waarop kanker zich verspreidt
- In planten is eenvoudige suiker het minst waarschijnlijk?
- Wat zijn enkele menselijke lichaamswoorden?
- Wat is wetenschapper in het Hindi?
- Wanneer nemen cellen hun unieke kenmerken aan?
- Wat gebeurt er als mitose verkeerd gaat?
- In het moderne classificatiesysteem zijn drie domeinen?
- Hoe de Chagas-pathogeen de darmmicrobiota van roofwantsen verandert
- Is de term cerebrale dominantie het halfrond aan dat dominant is voor taal?
- Bicyclische eiwitmimetica remmen het oncogen β-catenine
- Onderzoekers vinden waarde in ongebruikelijk type plantmateriaal

- Monitoring van de corrosie van bioresorbeerbaar magnesium

- Nieuwe geleiders met een hoog protonengehalte met inherent zuurstofarme lagen openen een duurzame toekomst
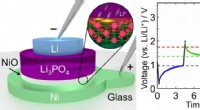
- Klein, snel, en zeer energiezuinig geheugenapparaat geïnspireerd op lithium-ionbatterijen
 Welke vorm is de molecule i3?
Welke vorm is de molecule i3?  Wat heeft de samenstelling van de atmosfeer veranderd?
Wat heeft de samenstelling van de atmosfeer veranderd?  Hypersonische raketten voeden nieuwe wereldwijde wapenwedloop
Hypersonische raketten voeden nieuwe wereldwijde wapenwedloop  Synthetische biologie om Mars te helpen koloniseren
Synthetische biologie om Mars te helpen koloniseren Cassini zendt eerste beelden uit nieuwe baan
Cassini zendt eerste beelden uit nieuwe baan Wat betekenen glucosemoleculen de bouwstenen van koolhydraten?
Wat betekenen glucosemoleculen de bouwstenen van koolhydraten?  Hoe wordt het bos beïnvloed door zure regen?
Hoe wordt het bos beïnvloed door zure regen?  Een nieuwe gletsjerwebsite uit de Oostenrijkse Alpen
Een nieuwe gletsjerwebsite uit de Oostenrijkse Alpen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

