
Wetenschap
Hoe wordt carbonzuur gevormd?
Hier is de chemische vergelijking:
co₂ + h₂o ⇌ h₂co₃
Deze reactie is omkeerbaar , wat betekent dat het in beide richtingen kan doorgaan. Onder normale omstandigheden ligt het evenwicht echter zwaar aan de links , wat betekent dat er veel meer opgelost co₂ is dan koolzuur in oplossing.
Hier is een uitsplitsing van het proces:
1. Co₂ lost op in water: Wanneer Co₂ in contact komt met water, lost het op in de vloeistof.
2. Hydratatie: Eenmaal opgelost, reageert CO₂ met watermoleculen om koolzuur te vormen.
3. evenwicht: De reactie bereikt het evenwicht, waarbij de vormingssnelheid van carbonzuur gelijk is aan de snelheid van de afbraak terug in co₂ en water.
Factoren die de vorming van koolzuur beïnvloeden:
* Druk: Hogere druk bevordert de vorming van koolzuur.
* Temperatuur: Lagere temperaturen geven de voorkeur aan de vorming van koolzuur.
* pH: Lagere pH (meer zuur) bevordert de vorming van koolzuur.
Belang van koolzuur:
Carbonzuur speelt een cruciale rol in verschillende biologische en geologische processen, waaronder:
* Bloedbuffering: Het helpt de pH van bloed te reguleren.
* verzuring van de oceaan: De absorptie van atmosferische co₂ in de oceaan vormt koolzuur, wat bijdraagt aan verzuring van de oceaan.
* Carble Mineral Formation: Carbonzuur reageert met mineralen om carbonaatrotsen zoals kalksteen te vormen.
Het is belangrijk op te merken dat koolzuur een zwak zuur is , wat betekent dat het slechts gedeeltelijk in oplossing is ioniseert. Dit betekent dat het niet gemakkelijk waterstofionen (H⁺) vrijgeeft, waardoor het minder corrosief is dan sterke zuren zoals zoutzuur (HCL).
 Wat wordt bij elkaar gehouden door een waterstofbrug?
Wat wordt bij elkaar gehouden door een waterstofbrug?  JCESR legt basis voor veiliger, batterijen die langer meegaan
JCESR legt basis voor veiliger, batterijen die langer meegaan Een nadere blik op de verbindingen en moleculen die betrokken zijn bij het geven van cannabis zijn unieke geur
Een nadere blik op de verbindingen en moleculen die betrokken zijn bij het geven van cannabis zijn unieke geur  Onderzoekers zorgen ervoor dat neurale netwerken met succes DNA-schade door UV-straling detecteren
Onderzoekers zorgen ervoor dat neurale netwerken met succes DNA-schade door UV-straling detecteren Wat is de definitie van limiettest voor anorganische verbinding?
Wat is de definitie van limiettest voor anorganische verbinding?
 Het verkeer blaten:schapen ontwijken auto's tijdens tour door Parijs
Het verkeer blaten:schapen ontwijken auto's tijdens tour door Parijs Methaanemissies van olie- en gasexploratie worden ondergerapporteerd
Methaanemissies van olie- en gasexploratie worden ondergerapporteerd Gesprekken om een rommelig juridisch gevecht over de emissieregels van Californië te voorkomen, lijken vastgelopen
Gesprekken om een rommelig juridisch gevecht over de emissieregels van Californië te voorkomen, lijken vastgelopen Microplastics remmen de groei van wormen:studie
Microplastics remmen de groei van wormen:studie Waarom heeft VAE de hoogste ecologische voetafdruk?
Waarom heeft VAE de hoogste ecologische voetafdruk?
Hoofdlijnen
- Soorten bacteriën in levensmiddelen
- Verspreiden bacteriën en virus zich op dezelfde manier?
- Welke naam wordt gegeven aan regio's die receptieve hormonen zijn?
- 15 nieuwe gekkosoorten ontdekt in Myanmar
- Wat is maïsplastic?
- Facebook-regels in één oogopslag:wat is er precies verboden?
- Wat is de erfelijke ziekte van exocriene klieren die leidt tot luchtwegobstructie?
- Whodunnit, als Aussie-reptielen uitsterven:studie (update)
- Wat is over reproductie?
- Lasertechniek kan de deur openen naar efficiëntere schone brandstoffen
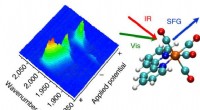
- Licht als hulpmiddel voor de synthese van complexe moleculen

- Waarom fotosynthese bij sommige planten beter werkt dan bij andere

- Afstemmen op de LCD's van morgen:de nieuwe IGZO-11 halfgeleider verkennen

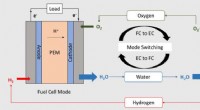
- Nieuwe katalysator helpt brandstofcel te combineren, batterij in één apparaat
 Wat is het product van C14H30 dat wordt verbrand als brandstof en zinkmetaal dat in een oplossing van koper-2-nitraat terechtkomt?
Wat is het product van C14H30 dat wordt verbrand als brandstof en zinkmetaal dat in een oplossing van koper-2-nitraat terechtkomt?  De volgende grote inspanning in AI:L.A.s water laten stromen na de aardbeving
De volgende grote inspanning in AI:L.A.s water laten stromen na de aardbeving Het vergelijken van cryogene structuren met monsters op kamertemperatuur kan helpen bij het identificeren van fouten in rekenmodellen
Het vergelijken van cryogene structuren met monsters op kamertemperatuur kan helpen bij het identificeren van fouten in rekenmodellen Wat doet het proces van fotosynthese?
Wat doet het proces van fotosynthese?  Prins William vertelt ruimtetoeristen:repareer in plaats daarvan de aarde
Prins William vertelt ruimtetoeristen:repareer in plaats daarvan de aarde Waarom is de kans kleiner dat consumenten een product kopen als dit de enige optie is?
Waarom is de kans kleiner dat consumenten een product kopen als dit de enige optie is?  36 miljoen hebben Amerikaanse werkloosheidshulp aangevraagd sinds het virus toesloeg
36 miljoen hebben Amerikaanse werkloosheidshulp aangevraagd sinds het virus toesloeg Hoeveel elektronen heeft het elementbarium?
Hoeveel elektronen heeft het elementbarium?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

