
Wetenschap
Hoe ziet een algemene zure basisreactie eruit?
HA + B ⇌ A⁻ + HB⁺
Waar:
* ha is de zuur , die een proton doneert (H⁺).
* B is de basis , die het proton accepteert.
* a⁻ is de conjugaatbasis van het zuur.
* hb⁺ is het conjugaatzuur van de basis.
Verklaring:
* zuur (ha) :Een zuur is een stof die een proton kan doneren (H⁺). In de reactie verliest HA een proton om zijn geconjugeerde basis A⁻ te vormen.
* base (b) :Een basis is een stof die een proton kan accepteren (H⁺). In de reactie krijgt B een proton van het zuur om zijn conjugaatzuur HB⁺ te vormen.
belangrijke punten:
* De reactie is een evenwichtsreactie , wat betekent dat het in zowel voorwaartse als omgekeerde richtingen kan doorgaan.
* De kracht van de zuur en de basis bepaalt de positie van het evenwicht. Sterkere zuren doneren protonen gemakkelijker, terwijl sterkere basen protonen gemakkelijker accepteren.
* De conjugaatzuurbasisparen bevinden zich altijd aan de tegenovergestelde zijden van het evenwicht.
Voorbeelden van algemene reacties met zuurbasis:
* HCl (zuur) + H₂o (base) ⇌ Cl⁻ (conjugaatbasis) + H₃o⁺ (conjugaatzuur)
* ch₃cooh (zuur) + nH₃ (base) ⇌ ch₃coo⁻ (conjugaatbasis) + nH₄⁺ (conjugaatzuur)
Opmerking:
* De algemene zuurbasisreactie is een brede definitie Dat omvat verschillende zuur-base theorieën zoals de Brønsted-Lowry-theorie en de Lewis-theorie.
* De specifieke vorm van de reactie kan variëren, afhankelijk van de specifieke betrokken zuur en base.
 Welke lessen moet je volgen op de middelbare school als je chemisch ingenieur wilt worden?
Welke lessen moet je volgen op de middelbare school als je chemisch ingenieur wilt worden?  Loop jij tegen waterstof aan?
Loop jij tegen waterstof aan?  Wat zijn enkele toepassingen van metalloïden?
Wat zijn enkele toepassingen van metalloïden?  Wat is het percentage zwavel in chalcopyriet?
Wat is het percentage zwavel in chalcopyriet?  Purdue drug discovery is gericht op het vinden van betere medicijnen, vermijd medicatietragedies zoals thalidomide
Purdue drug discovery is gericht op het vinden van betere medicijnen, vermijd medicatietragedies zoals thalidomide
 Door klimaatverandering zijn sommige vulkanische pluimen minder effectief in het verlagen van de mondiale temperatuur
Door klimaatverandering zijn sommige vulkanische pluimen minder effectief in het verlagen van de mondiale temperatuur Wetenschappers boren naar diepten in West-Antarctica
Wetenschappers boren naar diepten in West-Antarctica Reactie van wolken op vervuiling opgehelderd met nieuwe klimaatanalyse
Reactie van wolken op vervuiling opgehelderd met nieuwe klimaatanalyse Welke van de volgende is een karakteristieke postmoderne samenleving?
Welke van de volgende is een karakteristieke postmoderne samenleving?  Bliksem doodt 22 doden in Bangladesh
Bliksem doodt 22 doden in Bangladesh
Hoofdlijnen
- Wat is 1 voedsel dat bacteriën worden gebruikt om te maken?
- Oogstkracht:hoe theeplanten ziekten bestrijden terwijl ze zacht blijven
- Hoe eiwitten 'verborgen' DNA binden
- Onderzoekers ontcijferen hoe een enzym het genetisch materiaal in de celkern wijzigt
- Hoe noemde Darwin individuen die mutaties uitdrukken?
- Wat werken de verschillende soorten bloedcellen samen om immuunrespons te produceren?
- Wat zijn de belangrijkste verschillen tussen plantencellen en dierlijke cellen?
- Wat voor soort lipide vormt de dubbellaag die celmembranen vormt?
- Vogels onthullen het belang van goede buren voor gezondheid en veroudering
- Periodiek systeem ontdekt in St. Andrews erkend als oudste ter wereld

- Onderzoekers beschouwen de complexiteit van het bioprinten van meercellige weefsels
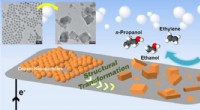
- Koperkatalysator zorgt voor een zeer efficiënte omzetting van CO2 naar brandstoffen
- Bier brouwen dat langer vers smaakt

- Nieuw, niet-invasieve bloedsuikertestmethoden met speeksel

 Is zwavel stollingsgesteente metamorf of sedimentair?
Is zwavel stollingsgesteente metamorf of sedimentair?  Wat zijn de stijve oppervlakken die een cel ondersteunen?
Wat zijn de stijve oppervlakken die een cel ondersteunen?  Wat gebeurt er wanneer twee magneten op de Noordpool samenkomen?
Wat gebeurt er wanneer twee magneten op de Noordpool samenkomen?  Bucky-balls maken in spin-outs-vizieren
Bucky-balls maken in spin-outs-vizieren Schadelijke moleculen detecteren met licht
Schadelijke moleculen detecteren met licht Het geheim van het volgen van dodelijke infecties? Het kan Mosquito Pee
Het geheim van het volgen van dodelijke infecties? Het kan Mosquito Pee Brug tussen kwantummechanica en algemene relativiteitstheorie nog steeds mogelijk
Brug tussen kwantummechanica en algemene relativiteitstheorie nog steeds mogelijk De juiste kneep voor quantum computing
De juiste kneep voor quantum computing
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

