
Wetenschap
Hoeveel chemische bindingen kunnen zuurstof maken?
Dit is waarom:
* valentie -elektronen: Zuurstof heeft zes elektronen in de buitenste schaal.
* octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele configuratie van acht elektronen in hun buitenste schaal (de octetregel) te bereiken.
* Bondvorming: Om een octet te bereiken, moet zuurstof nog twee elektronen krijgen. Het kan dit doen door twee covalente bindingen te vormen met andere atomen.
Voorbeelden:
* In water (H₂o) vormt zuurstof twee enkele bindingen met twee waterstofatomen.
* In koolstofdioxide (CO₂) vormt zuurstof een dubbele binding met een koolstofatoom.
Laat het me weten als je meer details wilt over specifieke soorten obligaties zuurstofvormen!
 Hittegolven op de oceaan en zwakkere wind zullen Australië nog een tijdje warm houden
Hittegolven op de oceaan en zwakkere wind zullen Australië nog een tijdje warm houden Alle levens zijn belangrijk:Indonesië redt tsunami-gestrande schildpadden
Alle levens zijn belangrijk:Indonesië redt tsunami-gestrande schildpadden Fossiele bladeren vertonen een hoge atmosferische koolstof die de oude wereldwijde vergroening heeft gestimuleerd
Fossiele bladeren vertonen een hoge atmosferische koolstof die de oude wereldwijde vergroening heeft gestimuleerd Een ingrijpend klimaatmodel van de Rode Zee
Een ingrijpend klimaatmodel van de Rode Zee Getijden spoelen niet altijd water naar zee, studie toont
Getijden spoelen niet altijd water naar zee, studie toont
Hoofdlijnen
- Wat is de wetenschappelijke definitie van woord cognitie?
- Wat is de dubbele helix?
- Hoe werken onze spieren? Wetenschappers onthullen belangrijke nieuwe inzichten in spiereiwitten
- Hoe insecten hun vleugels beheersen:de mysterieuze mechanica van insectenvluchten
- Hoe verschilt een cel aan het einde van de eerste fasecyclus van de tweede fase?
- Wereldwijde studie onthult groot vastgesteld netto risico voor zeldzame, gekoesterde NZ pinguïn
- Wat is de term voor een organisme met chromosoomaanduiding 3n?
- In welk deel van het oog komt er transductie op?
- Begrijpen hoe pathogene schimmels hun koolhydraatpantser opbouwen
- Zeer efficiënte katalysator met één atoom kan de auto-industrie helpen

- Wetenschappers ontcijferen het multi-domein, volledige structuur van de humane smoothened receptor
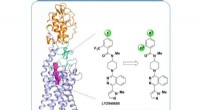
- Onderzoek vindt dat mechanisch aangedreven chemie reacties in explosieven versnelt

- Rekbare supercondensatoren om de draagbare apparaten van morgen van stroom te voorzien

- Levensbouwstenen waargenomen in een ruimteachtige omgeving
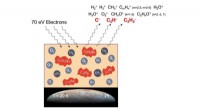
 Aboriginal tradities beschrijven de complexe bewegingen van planeten, de dwalende sterren van de hemel
Aboriginal tradities beschrijven de complexe bewegingen van planeten, de dwalende sterren van de hemel Nieuw onderzoek spoort wortels van krijgsgevangenen op
Nieuw onderzoek spoort wortels van krijgsgevangenen op Waarom zijn offshore-boringen zo controversieel?
Waarom zijn offshore-boringen zo controversieel?  Bevat regenwater stikstof?
Bevat regenwater stikstof?  Asteroïde mijnbouw op nog geen miljoen mijl afstand
Asteroïde mijnbouw op nog geen miljoen mijl afstand Overweeg je rustig te stoppen? Dit is waarom - en hoe - je in plaats daarvan met je baas zou moeten praten
Overweeg je rustig te stoppen? Dit is waarom - en hoe - je in plaats daarvan met je baas zou moeten praten  Ryanair schrapt meer vluchten naar Italië vanwege angst voor virus
Ryanair schrapt meer vluchten naar Italië vanwege angst voor virus Koel blijven met een zwarte halfgeleider
Koel blijven met een zwarte halfgeleider
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

