
Wetenschap
De lijnen in het heldere lijnspectrum van een atoom zijn te wijten aan wat?
Hier is een uitsplitsing:
* elektronen in atomen kunnen alleen bestaan op specifieke energieniveaus. Deze niveaus zijn gekwantiseerd, wat betekent dat ze alleen discrete waarden kunnen aannemen.
* Wanneer een elektron van een hoger energieniveau naar een lager gaat, geeft het energie vrij in de vorm van licht. De energie van het uitgezonden licht komt overeen met het verschil in energie tussen de twee niveaus.
* Aangezien de energieniveaus worden gekwantiseerd, heeft het uitgezonden licht specifieke golflengten. Dit resulteert in de heldere lijnen die in het spectrum worden gezien, elk overeenkomend met een bepaalde overgang van energieniveau.
Samenvattend:
1. Gehoogde elektronen: Elektronen zijn enthousiast over hogere energieniveaus.
2. Elektronenovergangen: Elektronen vallen terug naar lagere energieniveaus.
3. Lichtemissie: Energie wordt als licht vrijgegeven met specifieke golflengten.
4. Bright Line Spectrum: Het uitgezonden licht creëert een heldere lijnspectrum, waarbij elke lijn overeenkomt met een bepaalde overgang van energieniveau.
Dit is de reden waarom elk element een uniek heldere lijnspectrum heeft, zoals een vingerafdruk, waardoor we het kunnen identificeren.
 Wat is de atomaire massa van isotopen clorine?
Wat is de atomaire massa van isotopen clorine?  Wat gebeurt er in een halfvaste stof als de concentratie opgeloste stof toeneemt?
Wat gebeurt er in een halfvaste stof als de concentratie opgeloste stof toeneemt?  Welk type reactie gebruikt de waterstofbom?
Welk type reactie gebruikt de waterstofbom?  Een enzym dat in wasmiddel wordt gebruikt, kan plastic voor eenmalig gebruik binnen 24 uur recyclen
Een enzym dat in wasmiddel wordt gebruikt, kan plastic voor eenmalig gebruik binnen 24 uur recyclen  Oorzaken van aantasting van beton en asfalt uitgelegd
Oorzaken van aantasting van beton en asfalt uitgelegd
 Tandpasta Whitener Science Fair Project
Tandpasta Whitener Science Fair Project  Onderzoekers vinden een gezamenlijk overstromingsmodelleringsproces effectief
Onderzoekers vinden een gezamenlijk overstromingsmodelleringsproces effectief Wat betekent ding?
Wat betekent ding?  Vulkaanuitbarstingen hadden het afgelopen millennium grote en aanhoudende gevolgen voor het wereldwijde hydroklimaat
Vulkaanuitbarstingen hadden het afgelopen millennium grote en aanhoudende gevolgen voor het wereldwijde hydroklimaat Van rook die de wereld rondgaat tot aerosolniveaus, NASA observeert bosbranden in Australië
Van rook die de wereld rondgaat tot aerosolniveaus, NASA observeert bosbranden in Australië
Hoofdlijnen
- Wat is de functie van de zaadklier?
- Gevild karkas van zeeotter gevonden op strand in Californië
- Hoe denken wetenschappers?
- Wat is bioculturele diversiteit en waarom is het belangrijk?
- Wat zou er gebeuren in een menselijk lichaam dat zijn chromosomen heeft verloren op het moment dat de cel verdeelt zoals ze doen voor reparatie en regeneratie?
- Meld-en-klauwzeer:de lacunes in de inspanningen van Zuid-Afrika om het onder controle te houden
- Wie zorgt er bij vogelkoppels voor de kinderen?
- Wat zijn suikergombomen?
- Wordt nucleolus gevonden in planten- en dierlijke cellen?
- Membraanlaadsensor om de regulatie van onze T-cellen te bekijken
- Bionische idee stimuleert lithium-ion-extractie
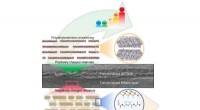
- Onderzoekers gebruiken aminozuren om hoogwaardige dunne koperfilms te laten groeien
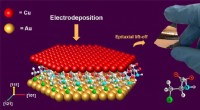
- Een betere koolstofvanger haalt broeikasgassen uit de lucht en zet ze in gebruik
- Screening op macrocyclische peptiden
 Defecten in diamant:een uniek platform voor optische gegevensopslag in 3D
Defecten in diamant:een uniek platform voor optische gegevensopslag in 3D  Team ontwikkelt zeer flexibele high-energy textiellithiumbatterij voor draagbare elektronica
Team ontwikkelt zeer flexibele high-energy textiellithiumbatterij voor draagbare elektronica Hoe militaire toepassingen in virtuele realiteit werken
Hoe militaire toepassingen in virtuele realiteit werken  Walmart koopt 77% van Indias Flipkart voor $ 16 miljard
Walmart koopt 77% van Indias Flipkart voor $ 16 miljard Oesterjagers verkennen rivieren op tekenen van schelpdierleven
Oesterjagers verkennen rivieren op tekenen van schelpdierleven Landen moeten samenwerken aan verwijdering van kooldioxide om gevaarlijke klimaatverandering te voorkomen
Landen moeten samenwerken aan verwijdering van kooldioxide om gevaarlijke klimaatverandering te voorkomen Wat is de oorzaak van release -energie van sterren?
Wat is de oorzaak van release -energie van sterren?  Kip van de zee? De tonijnteelt krijgt een impuls
Kip van de zee? De tonijnteelt krijgt een impuls
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

