
Wetenschap
Welke combinatie van metalen zou elektrolytische corrosie het meest uitgesproken zijn?
Hier is een uitsplitsing:
* Elektrochemische potentiaal: Dit is een maat voor de neiging van een metaal om te corroderen. Metalen met meer negatieve potentialen hebben meer kans om te corroderen.
* elektrolyt: Dit is een vloeistof of pasta die de stroom van ionen mogelijk maakt, waardoor het corrosieproces wordt vergemakkelijkt. Veel voorkomende voorbeelden zijn zeewater, zure oplossingen en zelfs vocht in de lucht.
Hier is een voorbeeld:
Stel je voor dat je een stalen pijp (ijzer) hebt aangesloten op een koperen buis. IJzer heeft een meer negatieve elektrochemisch potentieel dan koper. Als deze opstelling wordt blootgesteld aan een elektrolyt zoals zoutwater, gebeurt het volgende:
1. IJzer (meer negatieve potentiaal) werkt als de anode: Het verliest elektronen en corrodeert.
2. Koper (minder negatief potentieel) werkt als de kathode: Het krijgt elektronen en blijft beschermd.
3. De elektrolyt: Voert de elektronen van de anode naar de kathode uit, voltooit het circuit en faciliteert corrosie.
Hoe groter het verschil in elektrochemische potentialen, hoe meer uitgesproken de elektrolytische corrosie.
Voorbeelden van metaalcombinaties met hoge potentiële verschillen:
* staal (ijzer) en koper: Heel gebruikelijk in sanitaire systemen.
* Aluminium en roestvrij staal: Vaak gebruikt in de constructie.
* zink en messing: Gevonden in verschillende toepassingen.
Factoren die elektrolytische corrosie beïnvloeden:
* elektrolyt: De geleidbaarheid en samenstelling van de elektrolyt spelen een cruciale rol.
* Temperatuur: Hogere temperaturen versnellen corrosie.
* zuurstof: Zuurstof kan werken als een depolarizer en het corrosieproces versnellen.
* oppervlakte: Een groter oppervlak van het meer reactief metaal dat wordt blootgesteld aan de elektrolyt zal de corrosie verhogen.
Het voorkomen van elektrolytische corrosie:
* Gebruik ongelijksoortige metalen met vergelijkbare potentialen.
* Beschermende coatings aanbrengen: Verven, coatings en galvanisatie kunnen helpen.
* Gebruik kathodische bescherming: Dit omvat het verbinden van het meer reactieve metaal met een offeranode, die corrodeert in plaats van het beschermde metaal.
* Vermijd contact met elektrolyten: Houd metalen oppervlakken droog en schoon.
Vergeet niet dat het begrijpen van de principes van elektrolytische corrosie cruciaal is voor ingenieurs, ontwerpers en iedereen die betrokken is bij het selecteren en gebruiken van metalen in verschillende toepassingen.
 Onderzoekers maken doorbraak in antioxidant-enzym gekoppeld aan geelzucht
Onderzoekers maken doorbraak in antioxidant-enzym gekoppeld aan geelzucht Wanneer fluorgas door een oplossing van natriumbromide wordt geborreld, zijn de producten gratis broomvloeistof en fluoride erin?
Wanneer fluorgas door een oplossing van natriumbromide wordt geborreld, zijn de producten gratis broomvloeistof en fluoride erin?  Röntgenverstrooiing en moleculaire dynamica-simulaties die worden gebruikt om realtime beeldvorming van oxidatie van nanodeeltjes te maken
Röntgenverstrooiing en moleculaire dynamica-simulaties die worden gebruikt om realtime beeldvorming van oxidatie van nanodeeltjes te maken Polyproline beschermt celmonolagen tegen vorstschade
Polyproline beschermt celmonolagen tegen vorstschade Is het waar stikstofgas nodig om levende wezens te beschermen tegen schadelijke straling?
Is het waar stikstofgas nodig om levende wezens te beschermen tegen schadelijke straling?
 Australië stevent af op emissiehandel tussen grote vervuilers
Australië stevent af op emissiehandel tussen grote vervuilers Klimaat in gematigde graslanden
Klimaat in gematigde graslanden Saoedi-Arabië zal proberen zijn verslaving aan olie te verminderen
Saoedi-Arabië zal proberen zijn verslaving aan olie te verminderen  Hoe Nieuw-Zeeland de uitstoot sneller kan verminderen en minder afhankelijk kan zijn van compensaties om netto nul te bereiken
Hoe Nieuw-Zeeland de uitstoot sneller kan verminderen en minder afhankelijk kan zijn van compensaties om netto nul te bereiken Hoe planten evolueerden om van mieren hun dienaren te maken
Hoe planten evolueerden om van mieren hun dienaren te maken
Hoofdlijnen
- Het eerste onderzoek in zijn soort toont aan dat natuurbehoudsacties effectief zijn in het stoppen en omkeren van het verlies aan biodiversiteit
- Welke enzymen veroorzaakt de afbraak van bindweefsel in folliculaire cellen?
- Wilde megalopolis:onderzoek toont onverwachte gebieden met biodiversiteitspeper Los Angeles
- Is dit het begin van het einde van de plantenveredeling?
- DNA-studies tonen micro-evolutie aan bij pinguïns
- Welk type prokaryoten kunnen in de meest extreme omgevingen leven?
- Vroege systemen voor classificerende planten waren gebaseerd op kenmerken die mensen gemakkelijk konden zien omdat?
- Het echte verschil tussen plantaardige en dierlijke cellen
- Hoe cellen leren 'tellen'
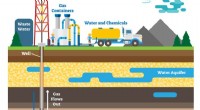
- Mechanisme dat verantwoordelijk is voor het maken van gehalogeneerde organische verbindingen bij fracken ontdekt
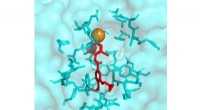
- Nieuwe methode om biofilmvorming te bevorderen en de efficiëntie van biokatalyse te verhogen

- Onderzoekers doen inspanningen om parasitaire rondwormen te bestrijden
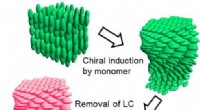
- Methode voor het maken van optisch actieve polymeren met behulp van een spiraalvormig vloeibaar-kristalsjabloon
- Micro-brouwen gaat meer micro

 Hoge GPA zou kunnen werken tegen jonge vrouwelijke werkzoekenden
Hoge GPA zou kunnen werken tegen jonge vrouwelijke werkzoekenden Wat zijn de eigenschappen van microbiële enzymen?
Wat zijn de eigenschappen van microbiële enzymen?  Het potentieel van agroforestry benutten
Het potentieel van agroforestry benutten Wat maakt evolutie tot een theorie?
Wat maakt evolutie tot een theorie?  Hoe noem je het pad van de aarde als het draait om de zon?
Hoe noem je het pad van de aarde als het draait om de zon?  De moeilijkheden van het verplaatsen van vloeistoffen in de ruimte gladstrijken
De moeilijkheden van het verplaatsen van vloeistoffen in de ruimte gladstrijken Astronomen jagen op afvallig superzwaar zwart gat
Astronomen jagen op afvallig superzwaar zwart gat Nieuwe inzichten in waarom de aardewerkproductie aan het einde van de laatste ijstijd aanzienlijk toenam
Nieuwe inzichten in waarom de aardewerkproductie aan het einde van de laatste ijstijd aanzienlijk toenam
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

