
Wetenschap
Wat zou het kookpunt zijn van 3,60 mol waterige sucrose -oplossing?
Inzicht in het concept
* Kookpunthoogte: Wanneer een opgeloste stof (zoals sucrose) wordt opgelost in een oplosmiddel (zoals water), neemt het kookpunt van de oplossing toe in vergelijking met het zuivere oplosmiddel. Dit staat bekend als kookpunthoogte.
* molaliteit: De concentratie van de oplossing wordt tot expressie gebracht in molaliteit (mol opgeloste stof per kilogram oplosmiddel). We moeten de molaliteit kennen om de hoogte van het kookpunt te berekenen.
* De formule: De kookpunthoogte (Δt b ) wordt berekend met behulp van de volgende formule:
Δt B =K B * M
Waar:
* Δt B is het kookpunthoogte
* K B is het molale kookpunthoogteconstante (voor water, k B =0,512 ° C/m)
* M is de molaliteit van de oplossing
Berekeningen
1. Ga uit van een massa water: Laten we voor de eenvoud aannemen dat we 1 kg (1000 g) water hebben.
2. Bereken molaliteit:
* Mol sucrose =3,60 mol
* Mass van water =1 kg
* Molaliteit (m) =(3,60 mol) / (1 kg) =3,60 mol / kg
3. Bereken het kookpunthoogte:
* Δt B =(0,512 ° C/m) * (3,60 mol/kg) =1,84 ° C
4. Bepaal het kookpunt:
* Het normale kookpunt van water is 100 ° C.
* Het kookpunt van de oplossing is 100 ° C + 1,84 ° C =101,84 ° C
Daarom zou het kookpunt van een 3,60 mol waterige sucrose -oplossing ongeveer 101,84 ° C zijn
belangrijke opmerkingen:
* Deze berekening veronderstelt het ideale gedrag van de oplossing, wat betekent dat er geen significante interacties zijn tussen de opgeloste en oplosmiddelmoleculen die het kookpunt zouden beïnvloeden.
* In werkelijkheid kan het werkelijke kookpunt enigszins verschillen als gevolg van niet-ideaal gedrag.
* Het is cruciaal om te werken met de molaliteit van de oplossing, niet bij het berekenen van het kookpunthoogte. Molaliteit is gebaseerd op de massa van het oplosmiddel, dat constant blijft, ongeacht temperatuurveranderingen.
 Volledig inkjet-geprinte op vanadiumdioxide gebaseerde radiofrequentieschakelaars voor flexibele herconfigureerbare componenten
Volledig inkjet-geprinte op vanadiumdioxide gebaseerde radiofrequentieschakelaars voor flexibele herconfigureerbare componenten Hoeveel protonen -neutronen en elektronen heeft een atoom van titanium?
Hoeveel protonen -neutronen en elektronen heeft een atoom van titanium?  Warmtevriendelijke microben bieden een efficiënte manier om plastic biologisch af te breken
Warmtevriendelijke microben bieden een efficiënte manier om plastic biologisch af te breken Waarom is katoen absorberend?
Waarom is katoen absorberend?  Ingenieurs ontwikkelen een plastic elektrode die uitrekt als rubber, maar elektriciteit transporteert als draden
Ingenieurs ontwikkelen een plastic elektrode die uitrekt als rubber, maar elektriciteit transporteert als draden
 Er is hoop te midden van angst voor het milieu, zegt een geleerde van ecotheologie
Er is hoop te midden van angst voor het milieu, zegt een geleerde van ecotheologie Wat zit er achter de edelstenen die uit de Kilauea-vulkaan regenen?
Wat zit er achter de edelstenen die uit de Kilauea-vulkaan regenen?  Welk van deze menselijke gedragingen heeft het grootste potentieel om het milieu te schaden?
Welk van deze menselijke gedragingen heeft het grootste potentieel om het milieu te schaden?  Antarctica:scheuren in het ijs
Antarctica:scheuren in het ijs Nauwkeurige voorspelling van orkaankracht versus oceaantemperatuur
Nauwkeurige voorspelling van orkaankracht versus oceaantemperatuur
Hoofdlijnen
- Bacterieel controlemechanisme voor aanpassing aan veranderende omstandigheden
- Welke omstandigheden kunnen de groei van bacteriën hebben bevorderd?
- Cytoplasma bacteriecellen
- Wat heeft uw lichaam nodig om te groeien en zichzelf te herstellen?
- Pythons zijn echte chokekunstenaars:grootte alleen verklaart niet hoe ze zulke grote prooien kunnen eten
- Wat is een selectief permeabel membraan en hoe werkt het?
- Hoe worden alle lichamen genoemd?
- Vraag en antwoord:Hoe je duurzame producten sneller kunt maken met kunstmatige intelligentie en automatisering
- Welk bewijs heb je voor de oorsprong van leven uit levenloze materie?
- Hoe werkt gekkotape?

- Niet alleen brood en bier:microben kunnen koolstofdioxide fermenteren om ook brandstof te maken
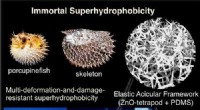
- Porcupinefish inspireert stevig superhydrofoob materiaal
- Studie biedt nieuwe inzichten voor technologieën voor het verzamelen van de zon

- Detectie van een ongekende reeks potentieel schadelijke stoffen in de lucht

 Psychologiestudie ontdekt dat vrijheid hand in hand gaat met religie, inclusief de islam
Psychologiestudie ontdekt dat vrijheid hand in hand gaat met religie, inclusief de islam Nieuw-Zeelandse gletsjers krimpen
Nieuw-Zeelandse gletsjers krimpen Wanneer is het sterrenbeeld Orian te zien?
Wanneer is het sterrenbeeld Orian te zien?  Welke atomen zijn in kalium?
Welke atomen zijn in kalium?  Waarom gifkikkers dat zelf niet doen
Waarom gifkikkers dat zelf niet doen  Zouden de chemische eigenschappen van fluor lijken op die van zuurstof of chloor?
Zouden de chemische eigenschappen van fluor lijken op die van zuurstof of chloor?  Ontdekt:onbekende gele kleuren uit de oudheid
Ontdekt:onbekende gele kleuren uit de oudheid Jakkes of jammie? Zwitsers aanbod insectenburgers van meelwormlarven
Jakkes of jammie? Zwitsers aanbod insectenburgers van meelwormlarven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

