
Wetenschap
Functies van de periodieke tabelelementen?
1. Organisatie en trends
* Perioden (rijen): Elementen in dezelfde periode hebben hetzelfde aantal elektronenschalen. Naarmate je een periode beweegt, neemt de atomaire straal af, neemt de ionisatie -energie toe en neemt de elektronegativiteit toe.
* groepen (kolommen): Elementen in dezelfde groep hebben hetzelfde aantal valentie -elektronen (elektronen in de buitenste schaal). Deze gelijkenis leidt tot soortgelijk chemisch gedrag en eigenschappen.
2. Functie op basis van elementtype
* metalen:
* Alkali -metalen (groep 1): Zeer reactief, verlies gemakkelijk één elektron om +1 ionen te vormen, waardoor ionische verbindingen worden gevormd. Gebruikt in batterijen, meststoffen en farmaceutische producten.
* alkalische aardmetalen (groep 2): Reactief, verlies twee elektronen om +2 ionen te vormen, gevonden in mineralen, bouwmaterialen en legeringen.
* overgangsmetalen (groepen 3-12): Vorm gekleurde verbindingen, goede geleiders van warmte en elektriciteit, gebruikt in legeringen, katalysatoren en pigmenten.
* Andere metalen: Diverse eigenschappen en toepassingen, waaronder structurele materialen (ijzer, aluminium), elektronica (koper, goud) en meer.
* niet -metalen:
* halogenen (groep 17): Zeer reactief, krijg één elektron om -1 -ionen te vormen, gebruikt in desinfectiemiddelen, pesticiden en geneesmiddelen.
* nobele gassen (groep 18): Niet -reactieve, stabiele elektronenconfiguraties, gebruikt in verlichting, lasers en medische beeldvorming.
* Andere niet -metalen: Diverse eigenschappen en toepassingen, inclusief gassen (zuurstof, stikstof), vaste stoffen (koolstof, zwavel) en vloeistoffen (broom).
* metalloïden (halfgeleiders):
* Vertonen eigenschappen van zowel metalen als niet -metalen, gebruikt in computerchips, transistoren en zonnecellen.
3. Specifieke voorbeelden
* waterstof (h): Het meest voorkomende element, essentieel voor water en organische verbindingen.
* koolstof (c): Vormt de ruggengraat van alle organische moleculen, essentieel voor het leven.
* zuurstof (O): Cruciaal voor ademhaling, water en vele verbindingen.
* stikstof (n): Een belangrijk onderdeel van de atmosfeer, essentieel voor eiwitten en DNA.
* natrium (Na) en chloor (CL): Vorm natriumchloride (tafelzout), essentieel voor het leven.
* ijzer (Fe): Een sterk, duurzaam metaal, gebruikt in constructie, gereedschap en transport.
* silicium (si): Een belangrijk onderdeel van halfgeleiders, gebruikt in computerchips en elektronica.
4. Beyond basisfuncties:
* isotopen: Atomen van hetzelfde element met verschillende aantallen neutronen, wat leidt tot variërende eigenschappen en toepassingen (bijv. Carbon-14 dating).
* legeringen: Mengsels van metalen met andere elementen, die nieuwe materialen creëren met gewenste eigenschappen (bijv. Bronze, staal).
* verbindingen: Elementen combineren op verschillende manieren om verbindingen te vormen met unieke eigenschappen en functies (bijvoorbeeld water, koolstofdioxide).
Onthoud: Het periodiek systeem is een dynamisch hulpmiddel dat de ingewikkelde relaties tussen elementen en hun functies weerspiegelt. Het is een basis voor het begrijpen van chemie en de wereld om ons heen.
Hoofdlijnen
- Waarom reproduceren zoogdieren?
- Onderzoek toont aan dat regenererende wormen genetische controle hebben over hun algenpartners
- Onderzoek toont aan hoe insecten gevangen zuurstof gebruiken om onder water te ademen
- De opkomst van royalty's:hoe arbeiderswespen specialisatie en plasticiteit in evenwicht brengen
- Hoeveel ziekten veroorzaakt door platwormen?
- Federale overheid:geen lijst van bedreigde soorten voor walrus
- Hoe helpen de flagella bacteriën rond te bewegen?
- Studie onthult hoe de adelborst zijn paar uur lang in stand houdt
- Wat is de functie van gelelektroforese?
- Cement, zout en water:een nieuw opslagmateriaal voor groene warmte

- Nieuwe kooien om moleculen te vangen, verleggen de grenzen van het eiwitontwerp
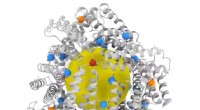
- Wetenschappers decoderen de dynamiek van de grootste eiwitafbrekende machine in atomaire details

- Een machine learning-oplossing voor het ontwerpen van materialen met gewenste optische eigenschappen

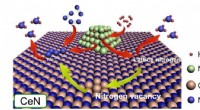
- De leegte in de ammoniaksynthese vullen:de rol van stikstofvacatures in katalysatoren
 Hebben vogels een goed reukvermogen?
Hebben vogels een goed reukvermogen?  Als de maan net deelneemt aan de afnemende gibbous fase, hoeveel dagen komt het de halve maanfase binnen?
Als de maan net deelneemt aan de afnemende gibbous fase, hoeveel dagen komt het de halve maanfase binnen?  Onderzoekers bespreken het MIT en Legacy of Slavery-project
Onderzoekers bespreken het MIT en Legacy of Slavery-project Samenvatting van een ecosysteem
Samenvatting van een ecosysteem  Hoe zijn wetenschapstechnologie en samenleving allemaal gerelateerd?
Hoe zijn wetenschapstechnologie en samenleving allemaal gerelateerd?  Van de 31 Australische politieke biografieën die in het afgelopen decennium zijn gepubliceerd, slechts 4 gingen over vrouwen
Van de 31 Australische politieke biografieën die in het afgelopen decennium zijn gepubliceerd, slechts 4 gingen over vrouwen Kunnen nieuwe Ultrabook-pc's lucht vangen?
Kunnen nieuwe Ultrabook-pc's lucht vangen?  GIMPS-project ontdekt grootste bekende priemgetal
GIMPS-project ontdekt grootste bekende priemgetal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


