
Wetenschap
Wat zijn alle elementen die reageren met aluminium?
elementen:
* zuurstof: Aluminium reageert gemakkelijk met zuurstof om een stoere, beschermende aluminiumoxide (al₂o₃) laag te vormen. Deze laag is zeer stabiel en voorkomt verdere oxidatie.
* halogenen: Aluminium reageert met halogenen zoals fluor (F₂), chloor (CL₂), broom (Br₂) en jodium (I₂) om aluminiumhalogeniden (bijv. Alcl₃) te vormen.
* zwavel: Aluminium reageert met zwavel om aluminiumsulfide (Al₂s₃) te vormen.
* stikstof: Bij hoge temperaturen kan aluminium reageren met stikstof om aluminiumnitride (ALN) te vormen.
Verbindingen:
* zuren: Aluminium reageert met sterke zuren zoals zoutzuur (HCL) en zwavelzuur (H₂SO₄) om waterstofgas af te geven en aluminiumzouten te vormen. Het is echter resistent tegen zwakke zuren zoals azijnzuur.
* Bases: Aluminium reageert met sterke basen zoals natriumhydroxide (NaOH) om aluminaten en waterstofgas te vormen.
* Water: Aluminium is relatief niet -reactief met water bij kamertemperatuur vanwege de beschermende oxidelaag. Bij hoge temperaturen en onder specifieke omstandigheden kan het echter reageren met water om waterstof en aluminiumhydroxide te produceren.
* metaaloxiden: Aluminium kan reageren met bepaalde metaaloxiden om het metaal te verplaatsen en aluminiumoxide te vormen. Dit staat bekend als de thermietreactie, die intense warmte produceert.
Andere reacties:
* elektrolyse: Aluminium kan elektrochemisch worden geëxtraheerd uit zijn erts (bauxiet) met behulp van elektrolyse.
* verbranding: Aluminium poeder brandt helder in lucht en laat een grote hoeveelheid warmte en licht vrij.
factoren die de reactiviteit beïnvloeden:
* Temperatuur: Hogere temperaturen verhogen in het algemeen de reactiesnelheid met aluminium.
* Aanwezigheid van een beschermende laag: De aanwezigheid van de aluminiumoxidelaag vertraagt aanzienlijk verdere reacties.
* concentratie: Hogere concentraties reactanten leiden in het algemeen tot snellere reacties.
* oppervlakte: Een groter oppervlak zorgt voor meer contact tussen reactanten en verhoogt de reactiesnelheid.
Opmerking: Dit is geen uitputtende lijst en er kunnen andere specifieke reacties zijn die hier niet worden genoemd.
 Onderzoekers ontwikkelen micro-organismen om vervuiling door PET-plastic aan te pakken
Onderzoekers ontwikkelen micro-organismen om vervuiling door PET-plastic aan te pakken Georganiseerde chaos in het enzymcomplex - verrassende inzichten en nieuwe perspectieven
Georganiseerde chaos in het enzymcomplex - verrassende inzichten en nieuwe perspectieven Welke scheidingsprocedures scheiden olie van zout water?
Welke scheidingsprocedures scheiden olie van zout water?  Is aluminium een metaal of een niet-metaal?
Is aluminium een metaal of een niet-metaal?  Maak een lijst van enkele factoren die de diffusiesnelheid zouden verhogen
Maak een lijst van enkele factoren die de diffusiesnelheid zouden verhogen
 Nieuwe analyse toont aan dat zeegrasweiden in Guam met 22 procent zijn afgenomen
Nieuwe analyse toont aan dat zeegrasweiden in Guam met 22 procent zijn afgenomen Voet sneeuw bedekt delen van Midwest, verstoort het reizen (update)
Voet sneeuw bedekt delen van Midwest, verstoort het reizen (update) Wetenschappers identificeren hoe de ontleding van Arctische landschappen verandert door de steeds snellere klimaatverandering
Wetenschappers identificeren hoe de ontleding van Arctische landschappen verandert door de steeds snellere klimaatverandering  Studie zegt dat ontboste gebieden in de Amazone kwetsbaar zijn voor verlies van wettelijke bescherming
Studie zegt dat ontboste gebieden in de Amazone kwetsbaar zijn voor verlies van wettelijke bescherming Meststoffen passen de stikstofcyclus van prairieplanten aan, volgens nieuwe studie
Meststoffen passen de stikstofcyclus van prairieplanten aan, volgens nieuwe studie
Hoofdlijnen
- Wat doet de gladde ER in een dierencel?
- Wat zijn de eigenschappen van een enzym?
- Genomische studie onderzoekt de evolutie van zachte killer-bijen in Puerto Rico
- Seizoensgedrag bij planten en dieren wordt gestimuleerd door?
- Welke ontdekkingen zijn zeevloerkenmerken gevonden met Aqualung?
- Waarom Hydrolyse lactose niet hydrolyseert?
- Wat zijn enkele nadelen van de hermafrodietstaat bij dieren?
- Wat is de oorzaak van het bestaan?
- Bij mensen welke structuur voorkomt dat voedsel de tranchea binnengaat?
- Wetenschappers ontwikkelen stereogedefinieerde N- en S-atoom-gecodeerde graphdiyne voor zuurstofevolutie
- Experimentele studie van hoe metallisch glas een uitdaging vormt voor het paradigma in glasonderzoek

- niet giftig, biologisch afbreekbaar orthopedisch implantaat kan superieure ondersteuning bieden aan beschadigde botten
- Nobelprijs Scheikunde:Grote onderscheiding voor moleculaire zaken

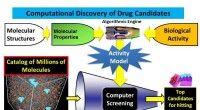
- Algoritme leidt tot een dramatische verbetering van methoden voor het ontdekken van geneesmiddelen
 Weinig reden voor morele paniek na #MeToo
Weinig reden voor morele paniek na #MeToo Ultrasnel schakelen op afstand van lichtemissie
Ultrasnel schakelen op afstand van lichtemissie Miami stelt een ambitieus emissiedoel:koolstofneutraal in 2050. Hoe dat te bereiken is niet duidelijk
Miami stelt een ambitieus emissiedoel:koolstofneutraal in 2050. Hoe dat te bereiken is niet duidelijk  Facebook verwerpt Australische media-oproepen voor regulering
Facebook verwerpt Australische media-oproepen voor regulering Wat zijn 2 delen poeder op één deel water?
Wat zijn 2 delen poeder op één deel water?  Fasen in de levenscyclus van een ster
Fasen in de levenscyclus van een ster  Hoe werken de structuren in een dierencel?
Hoe werken de structuren in een dierencel?  Natuurbeschermers bevestigen opnieuw een aanval op grijze wolven in Jackson County in Colorado
Natuurbeschermers bevestigen opnieuw een aanval op grijze wolven in Jackson County in Colorado
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

