
Wetenschap
Wat is carbon-12 en carbon-14?
Hier is een uitsplitsing van elk:
carbon-12 (¹²C)
* Atomisch nummer: 6 (wat betekent dat het 6 protonen heeft)
* Massienummer: 12 (wat betekent dat het 6 protonen + 6 neutronen heeft)
* overvloed: ~ 98,9% van alle koolstof op aarde
* stabiliteit: Stabiele isotoop
* Gebruik: De basis voor de Atomic Mass Unit (AMU)
carbon-14 (¹⁴C)
* Atomisch nummer: 6 (wat betekent dat het 6 protonen heeft)
* Massienummer: 14 (wat betekent dat het 6 protonen + 8 neutronen heeft)
* overvloed: Spoorhoeveelheden (ongeveer 1 deel per biljoen)
* stabiliteit: Radioactieve isotoop met een halfwaardetijd van 5.730 jaar
* Gebruik:
* Radiocarbon Dating: Wetenschappers gebruiken het verval van koolstof-14 om de leeftijd van oude artefacten en fossielen te bepalen.
* Biologische processen traceren: Carbon-14 wordt gebruikt om de beweging van koolstof te volgen door levende organismen.
Belangrijkste verschillen:
* Aantal neutronen: Carbon-14 heeft nog twee neutronen dan koolstof-12.
* stabiliteit: Carbon-12 is stabiel, terwijl koolstof-14 radioactief is en in de loop van de tijd vervalt.
* overvloed: Carbon-12 is veel overvloediger dan koolstof-14.
* Toepassingen: Carbon-12 is de standaard voor atomaire massa, terwijl koolstof-14 wordt gebruikt voor dating en traceren.
In wezen, hoewel beide isotopen koolstof zijn, geven hun verschillende neutronen hun unieke eigenschappen die ze nuttig maken op verschillende wetenschappelijke velden.
 Punjab tekstboekbord Lahore scheikunde van 10 uur les?
Punjab tekstboekbord Lahore scheikunde van 10 uur les?  Door microzwaartekracht gegroeide kristallen onthullen nieuwe inzichten in eiwitstructuren
Door microzwaartekracht gegroeide kristallen onthullen nieuwe inzichten in eiwitstructuren  Wat zijn 3 factoren die het gasgedrag beïnvloeden?
Wat zijn 3 factoren die het gasgedrag beïnvloeden?  Optische interferometrie visualiseert hoe vaak lelies vluchtige organische stoffen uitstoten
Optische interferometrie visualiseert hoe vaak lelies vluchtige organische stoffen uitstoten  Wetenschappers onthullen stapsgewijze hydratatiemotieven van zwaveldioxide
Wetenschappers onthullen stapsgewijze hydratatiemotieven van zwaveldioxide
 Port Fourchon beschermen:wetenschappers leggen uit hoe sediment kan worden beheerd om landverlies te voorkomen en orkaanvoorbereiding te verbeteren
Port Fourchon beschermen:wetenschappers leggen uit hoe sediment kan worden beheerd om landverlies te voorkomen en orkaanvoorbereiding te verbeteren Boeren in Myanmar gaan tegen de stroom in met apps
Boeren in Myanmar gaan tegen de stroom in met apps Wie heeft er meer voedselplanten of dieren nodig?
Wie heeft er meer voedselplanten of dieren nodig?  Everglades laten een verbetering van de waterkwaliteit zien
Everglades laten een verbetering van de waterkwaliteit zien  Onderhouden van waardevolle bodems
Onderhouden van waardevolle bodems
Hoofdlijnen
- Wat zijn etercellen?
- Nieuw mechanisme verduidelijkt hoe cellen migreren
- Wie kwam er met celtheorie?
- Het geheim van een langere levensduur? Genregulatie houdt een aanwijzing in
- Wat wordt gemaakt door organisme met de genotype TTSS?
- Indringende vraag:Moet de samenleving reproductieve technologieën reguleren?
- Welk eiwit vormt een spons?
- Nieuwe AI-tool legt vast hoe eiwitten zich in context gedragen
- Dino-dodende asteroïde versnelde evolutie van vogels
- Nieuwe aanpak om peptidestapeling algemeen beschikbaar te maken
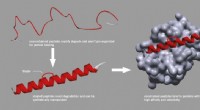
- Voedingswetenschappers creëren nieuwe magnetische nanodeeltjes voor snelle screening van bestrijdingsmiddelenresiduen in groenten

- Een reactie op preparatieve schaal met behulp van platinaclusters met een gerealiseerde eencijferige atomiciteit
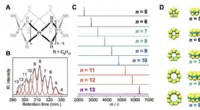
- Nieuwe ontdekking van cellulose kan leiden tot nieuwe chemicaliën, biobrandstoffen
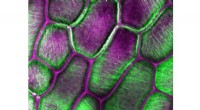
- 4-D bio-engineering materialen buigen, kromming als natuurlijk weefsel
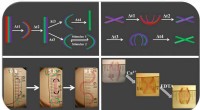
 Hoe politierobots werken
Hoe politierobots werken  Half miljard jaar oude fossielen bieden nieuwe aanwijzingen voor hoe het leven op de zeebodem explodeerde
Half miljard jaar oude fossielen bieden nieuwe aanwijzingen voor hoe het leven op de zeebodem explodeerde  Huawei beschuldigt VS van cyberaanvallen werknemers dwingen
Huawei beschuldigt VS van cyberaanvallen werknemers dwingen Waarom sommige steden 's nachts de waterleidingen afsluiten
Waarom sommige steden 's nachts de waterleidingen afsluiten  Vervuild grondwater heeft waarschijnlijk al tientallen jaren de koraalriffen in de Zuidelijke Stille Oceaan verontreinigd
Vervuild grondwater heeft waarschijnlijk al tientallen jaren de koraalriffen in de Zuidelijke Stille Oceaan verontreinigd Menselijk oog dat spookbeelden kan zien
Menselijk oog dat spookbeelden kan zien Weet jij waarom en hoe je wachtwoorden vergeet?
Weet jij waarom en hoe je wachtwoorden vergeet?  Wat is een dubbele vervangingsreactie?
Wat is een dubbele vervangingsreactie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

