
Wetenschap
Wat zit er in een molecuul beïnvloedt de manier waarop die reageert?
1. Moleculaire structuur en binding:
* Functionele groepen: Specifieke groepen atomen binnen een molecuul (zoals hydroxyl-, carbonyl- of aminegroepen) geven verschillende reactiviteit. Een carbonylgroep is bijvoorbeeld vatbaar voor nucleofiele aanval, terwijl een hydroxylgroep kan fungeren als een nucleofiel of een vertrekkende groep.
* Bindingssterkten en polariteit: Sterke bindingen vereisen meer energie om te breken, waardoor moleculen minder reactief worden. Polaire bindingen, waar elektronen ongelijk worden gedeeld, kunnen gebieden van gedeeltelijke positieve en negatieve lading creëren, wat beïnvloedt hoe een molecuul interageert met andere moleculen.
* Moleculaire geometrie: De vorm van een molecuul bepaalt hoe het kan interageren met andere moleculen. Een lineair molecuul kan bijvoorbeeld minder reactief zijn dan een vertakt molecuul.
2. Elektronische eigenschappen:
* Elektronendichtheid: Gebieden met een hoge elektronendichtheid hebben meer kans om elektrofielen aan te trekken (elektronenminnende soorten), terwijl regio's met een lage elektronendichtheid vaker nucleofielen aantrekken (elektronenrijke soorten).
* orbitale overlap: De mate van overlapping tussen orbitalen van verschillende atomen beïnvloedt de sterkte en het type chemische binding gevormd, waardoor de reactiviteit direct wordt beïnvloed.
3. Omgevingsfactoren:
* Temperatuur: Hogere temperaturen bieden meer energie om activeringsenergieën te overwinnen, waardoor de reactiesnelheid wordt verhoogd.
* oplosmiddel: De polariteit en eigenschappen van het oplosmiddel kunnen de snelheid en het type reactie beïnvloeden door tussenproducten te stabiliseren of te destabiliseren.
* pH: De zuurgraad of basiciteit van het milieu kan de ionisatietoestand van functionele groepen beïnvloeden, wat hun reactiviteit beïnvloedt.
* katalysator: Een katalysator verlaagt de activeringsenergie van een reactie en versnelt het proces zonder te worden geconsumeerd.
4. Thermodynamica:
* Enthalpy Change (ΔH): De verandering in warmte -energie tijdens een reactie; Exotherme reacties geven warmte vrij en zijn gunstiger.
* Entropie -verandering (AS): De verandering in wanorde tijdens een reactie; Reacties die de wanorde vergroten, zijn gunstiger.
* Gibbs Free Energy (ΔG): Een maat voor de spontaniteit van een reactie; Een negatieve Ag geeft een spontane reactie aan.
Samenvattend wordt de reactiviteit van een molecuul bepaald door een complex samenspel van zijn structuur, elektronische eigenschappen en omgevingsfactoren. Het begrijpen van deze factoren is cruciaal voor het voorspellen en beheersen van chemische reacties.
 Onderzoekers onderzoeken enzymen die een kation gebruiken, geen zuurstoftoevoeging, om reacties te stimuleren
Onderzoekers onderzoeken enzymen die een kation gebruiken, geen zuurstoftoevoeging, om reacties te stimuleren Waarom is natriumhydroxide sterker dan ammoniak?
Waarom is natriumhydroxide sterker dan ammoniak?  Suiker lost op in water sneller dan zoutwetenschappelijke projecten
Suiker lost op in water sneller dan zoutwetenschappelijke projecten Scholes vindt nieuw magnetisch veldeffect in diamagnetische moleculen
Scholes vindt nieuw magnetisch veldeffect in diamagnetische moleculen Wetenschappers verbeteren kleur en textuur van kweekvlees
Wetenschappers verbeteren kleur en textuur van kweekvlees
 Hoe heet kunnen hittegolven worden? Klimaatexpert bespreekt recordtemperaturen
Hoe heet kunnen hittegolven worden? Klimaatexpert bespreekt recordtemperaturen Hoe beïnvloedt microzwaartekracht de botten en spieren van astronauten?
Hoe beïnvloedt microzwaartekracht de botten en spieren van astronauten?  Hoe ontstaat versteend hout?
Hoe ontstaat versteend hout?  Ammoniak ontbrak bij het weergeven van de gevolgen van luchtverontreiniging
Ammoniak ontbrak bij het weergeven van de gevolgen van luchtverontreiniging Na netto nul, we zullen veel verder moeten gaan en historische emissies opruimen
Na netto nul, we zullen veel verder moeten gaan en historische emissies opruimen
Hoofdlijnen
- Waarom verspreiden bloeiende planten hun zaden?
- Hoe goede darmbacteriën het risico op hartziekten helpen verminderen
- Hoe werken rode bloedcellen en botten samen?
- Nieuwe Japanse leliesoort geïdentificeerd, eerste toevoeging aan de sukashiyuri-groep in 110 jaar
- Zijn antigeen in combinatie met oligosachariden?
- Zijn eiwitdierlijke cellen of plantencellen?
- Onderzoek voorspelt hoe het eekhoornpokkenvirus zich zou kunnen verspreiden in grijze eekhoornpopulaties
- Wat zal hoogstwaarschijnlijk voorkomen wanneer een cel in zoutoplossing wordt geplaatst met een hogere zoutconcentratie dan de cel?
- Kun je mij een zin geven waarin het woord celmembraan wordt gebruikt?
- Biologische medicijnen maken met spinnenzijde-eiwit

- Ontdekking kan microverontreinigingen uit het milieu verwijderen

- Chitinase als verbrande brug Brownse monorail die op efficiënte wijze recalcitrante biomassa hydrolyseert
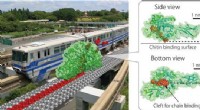
- Titan-supercomputer analyseert bacterieel fotosynthesesysteem
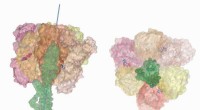
- Onderzoekers kunnen nu snel nauwkeurig scannen op nutriëntengehalte in het gangpad met producten

 Chemische topologie van silica kan de effectiviteit van veel chemische processen die het gebruiken beïnvloeden
Chemische topologie van silica kan de effectiviteit van veel chemische processen die het gebruiken beïnvloeden China's ruimtedroom:een lange mars naar de maan en verder
China's ruimtedroom:een lange mars naar de maan en verder Geleidelijke en sporadische veranderingen vinden voortdurend plaats in de natuur in het hele universum. Welke biologische term wordt gebruikt om deze veranderingen te beschrijven?
Geleidelijke en sporadische veranderingen vinden voortdurend plaats in de natuur in het hele universum. Welke biologische term wordt gebruikt om deze veranderingen te beschrijven?  Wat is de lengtegraad en breedtegraad van Taronga Zoo?
Wat is de lengtegraad en breedtegraad van Taronga Zoo?  Rederijen kijken naar de toekomst
Rederijen kijken naar de toekomst Lussen van vloeibaar metaal kunnen toekomstige fusiecentrales verbeteren, wetenschappers zeggen:
Lussen van vloeibaar metaal kunnen toekomstige fusiecentrales verbeteren, wetenschappers zeggen: Eenvoudige methode meet hoe lang bacteriën kunnen wachten op antibiotica
Eenvoudige methode meet hoe lang bacteriën kunnen wachten op antibiotica Walmart-winsten raken op, maar de inkomsten stijgen naarmate online groeit
Walmart-winsten raken op, maar de inkomsten stijgen naarmate online groeit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

