
Wetenschap
Wat is wanneer moleculen tot elkaar worden aangetrokken maar niet worden besteld?
* Attractie: Vloeistoffen hebben sterk genoeg intermoleculaire krachten (zoals waterstofbruggen, dipool-dipoolinteracties of Londense dispersiekrachten) om de moleculen bij elkaar te houden.
* Gebrek aan bestelling: In tegenstelling tot vaste stoffen, waarbij moleculen star zijn gerangschikt in een kristalrooster, hebben vloeistoffen minder orde. Hun moleculen beweegt zich constant en botst tegen elkaar, wat resulteert in een meer vloeiende en minder georganiseerde structuur.
Hier is een eenvoudige analogie: Stel je een drukke dansvloer voor. Mensen zijn dicht bij elkaar (aantrekkingskracht), maar ze bewegen allemaal vrij rond en botsen tegen elkaar (gebrek aan orde). Dat is een beetje zoals hoe moleculen zich in een vloeistof gedragen.
 Grote kijk op de impact van klimaatverandering op de Amerikaanse landbouw:het middenwesten loopt gevaar
Grote kijk op de impact van klimaatverandering op de Amerikaanse landbouw:het middenwesten loopt gevaar Stof in de lucht bedreigt de menselijke gezondheid in het zuidwesten
Stof in de lucht bedreigt de menselijke gezondheid in het zuidwesten Wespen die 's nachts vliegen
Wespen die 's nachts vliegen  Hoe wormen de biodiversiteitsexplosie op aarde vormden
Hoe wormen de biodiversiteitsexplosie op aarde vormden  Drijvende robots laten zien hoeveel stof in de lucht de Zuidelijke Oceaan bevrucht – een belangrijke klimaatschokdemper
Drijvende robots laten zien hoeveel stof in de lucht de Zuidelijke Oceaan bevrucht – een belangrijke klimaatschokdemper
Hoofdlijnen
- Welke structuur vertelt u dat Euglena getoont een autotrofe is?
- Wat zijn de functies van Cerebelum?
- Wat zijn de twee kenmerken van zoogdieren?
- Wat is het meest zichtbare kenmerk van protozoën?
- Wat betekent weefsel?
- Waarom zijn de nakomelingen van oudere moeders minder geschikt om lang en voorspoedig te leven?
- Wat zijn drie manieren waarop wetenschappers hun ideeën delen?
- Is de eerste laag van een plantencelwand of membraan?
- IJzer-zwavelmineralen kunnen getuigen van de eerste microben op aarde die miljarden jaren geleden leefden
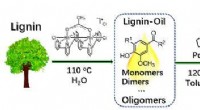
- Nieuwe strategie ontworpen voor duurzame productie van benzylamines uit lignine
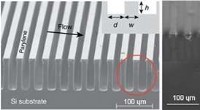
- Stromend zout water over dit superhydrofobe oppervlak kan elektriciteit opwekken
- Teamwetenschap leidt tot doorbraak in kooldioxideomzetting

- Onderzoekers ontwikkelen verbeterd recyclingproces voor koolstofvezels

- Onderzoekers creëren smartphonesysteem om te testen op lood in water

 Hoe deelbaar door uit te drukken in Excel
Hoe deelbaar door uit te drukken in Excel  Antivries, goedkope materialen kunnen leiden tot goedkope zonne-energie
Antivries, goedkope materialen kunnen leiden tot goedkope zonne-energie Welke soorten cellen en organismen ondergaan mitose en meiose?
Welke soorten cellen en organismen ondergaan mitose en meiose?  Nieuwe zeer selectieve antitumor fotodynamische therapiemiddelen gesynthetiseerd
Nieuwe zeer selectieve antitumor fotodynamische therapiemiddelen gesynthetiseerd Vergelijken en contrasteren met een gematigd bioom en een Taiga Biome
Vergelijken en contrasteren met een gematigd bioom en een Taiga Biome Afrikaanse ruimtehavens verlagen brandstofkosten voor raketten
Afrikaanse ruimtehavens verlagen brandstofkosten voor raketten Hoe wordt het genoemd als deeltjes over elkaar kunnen stromen?
Hoe wordt het genoemd als deeltjes over elkaar kunnen stromen?  Berichten van 's werelds kleinste ruimtesonde
Berichten van 's werelds kleinste ruimtesonde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

