
Wetenschap
Wanneer is een obligatie polair?
Hier is een uitsplitsing:
* elektronegativiteit: Dit is een maat voor het vermogen van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding.
* Verschil in elektronegativiteit: Wanneer er een significant verschil is in elektronegativiteit tussen twee gebonden atomen, zal het meer elektronegatief atoom de gedeelde elektronen dichter bij zichzelf trekken. Dit creëert een gedeeltelijke negatieve lading (Δ-) op het meer elektronegatieve atoom en een gedeeltelijke positieve lading (A+) op het minder elektronegatieve atoom.
* Polaire binding: Deze ongelijke delen van elektronen leidt tot een polaire binding , waarbij het ene uiteinde van de binding enigszins negatief is en het andere uiteinde enigszins positief is.
Voorbeeld:
* De binding tussen waterstof (H) en zuurstof (O) in water (H₂o) is een polaire binding. Zuurstof is elektronegatiefer dan waterstof, dus trekt het de gedeelde elektronen dichter bij zichzelf, waardoor het zuurstofatoom enigszins negatief is en de waterstofatomen enigszins positief.
Belangrijke opmerking:
* De mate van polariteit in een binding wordt bepaald door het verschil in elektronegativiteit tussen de atomen. Hoe groter het verschil, hoe meer polair de binding.
* Een binding wordt beschouwd als nonpolar Wanneer het elektronegativiteitsverschil tussen de atomen erg klein of nul is. Dit treedt meestal op wanneer de twee atomen hetzelfde element zijn.
Laat het me weten als je meer voorbeelden wilt of specifieke obligaties wilt bespreken!
 Hoe worden chemische vergelijkingen in evenwicht gebracht door de subscripts van moleculen waar of onwaar te veranderen?
Hoe worden chemische vergelijkingen in evenwicht gebracht door de subscripts van moleculen waar of onwaar te veranderen?  Wetenschappers ontdekken dat oud antibioticum selectief gevaarlijke huidkankercellen kan doden
Wetenschappers ontdekken dat oud antibioticum selectief gevaarlijke huidkankercellen kan doden Onderzoek naar gloeiende glasdruppels op het ISS
Onderzoek naar gloeiende glasdruppels op het ISS Moet het woord chemie worden gekapitaliseerd?
Moet het woord chemie worden gekapitaliseerd?  Alcohol omzetten in belangrijke ingrediënten voor nieuwe medicijnen
Alcohol omzetten in belangrijke ingrediënten voor nieuwe medicijnen
Hoofdlijnen
- Een kijkje in de geest van de hond:nieuw onderzoek onthult hoe honden over hun speelgoed denken
- Wat is de geslachts- en soortnaam van een plant?
- Nieuw zenuwdegeneratiemolecuul geïdentificeerd
- 'Wat als er een stoere Barbie bestond?' Barbie's genderpolitiek onderzocht
- Waarom hebben Halobacter -organismen aangepast aan een hoge zoutconcentratie?
- Wat doet het cerebrum dat verantwoordelijk is voor de hersenen?
- Waarom is de zon zo helder?
- Een gewone parasiet zou medicijnen naar de hersenen kunnen brengen – hoe wetenschappers Toxoplasma gondii van vijand in vriend veranderen
- Wat betekent monster in de wetenschap?
- Nieuwe eiwitstructuren om rationeel medicijnontwerp te ondersteunen
- Natuurkundig team onderzoekt invloed van ionen op atomaire bewegingen

- Wetenschappers sturen bacteriën met uitgebreide genetische code om extreme hittetolerantie te ontwikkelen
- Hydrogel bevordert wondgenezing beter dan traditionele zwachtels, gaasjes
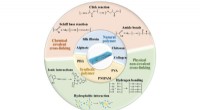
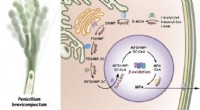
- Mysterie van de biosynthese van immunosuppressiva eindelijk ontgrendeld
 Mijlpaal in het upgradeproject voor geavanceerde lichtbronnen zal een nieuwe ring opleveren
Mijlpaal in het upgradeproject voor geavanceerde lichtbronnen zal een nieuwe ring opleveren Nieuwe 3D-modellen laten zien hoe het opwarmende klimaat de getijden onder water beïnvloedt
Nieuwe 3D-modellen laten zien hoe het opwarmende klimaat de getijden onder water beïnvloedt  Volledige structuur van mitochondriaal respiratoir supercomplex gedecodeerd
Volledige structuur van mitochondriaal respiratoir supercomplex gedecodeerd Wat is cyclische AMP -concentratie?
Wat is cyclische AMP -concentratie?  De kosten van ethanol verlagen, andere biobrandstoffen en benzine
De kosten van ethanol verlagen, andere biobrandstoffen en benzine Wetenschappers vinden een mobiel back-upplan om het ijzergehalte precies goed te houden
Wetenschappers vinden een mobiel back-upplan om het ijzergehalte precies goed te houden Hoe exploderende mangaten werken
Hoe exploderende mangaten werken  Te drogen gelaten:een efficiëntere manier om algenbiomassa te oogsten
Te drogen gelaten:een efficiëntere manier om algenbiomassa te oogsten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

