
Wetenschap
Wat zijn de beste omstandigheden om een gas in vloeistof op te lossen?
1. Hoge druk:
* Verklaring: Het vergroten van de druk dwingt de gasmoleculen dichter bij elkaar, waardoor hun kansen op botsen met het oppervlak van de vloeistof worden vergroot en oplost. Dit wordt beschreven door de wet van Henry, die stelt dat de oplosbaarheid van een gas in een vloeistof recht evenredig is met de partiële druk van het gas boven de vloeistof.
* Voorbeeld: Koolstofdioxide is meer oplosbaar in frisdrank onder hoge druk, en daarom gaat frisdrank plat wanneer geopend (de druk daalt).
2. Lage temperatuur:
* Verklaring: Het verlagen van de temperatuur verlaagt de kinetische energie van gasmoleculen, waardoor ze minder kans hebben om uit de vloeistof terug in de gasfase te ontsnappen.
* Voorbeeld: U kunt meer zuurstof in koud water oplossen dan in warm water, daarom ondersteunt koud water meer waterleven.
3. Hoge polariteit van de vloeistof:
* Verklaring: Gassen lossen beter op in vloeistoffen die vergelijkbare polariteiten hebben. Polaire vloeistoffen (zoals water) hebben de neiging polaire gassen (zoals ammoniak) op te lossen. Niet -polaire vloeistoffen (zoals olie) hebben de neiging om niet -polaire gassen (zoals methaan) op te lossen.
* Voorbeeld: Koolstofdioxide, een enigszins polair gas, is meer oplosbaar in water (polair) dan in olie (niet -polair).
4. Roeren of agitatie:
* Verklaring: Agitatie helpt het oppervlak tussen het gas en de vloeistof te vergroten, waardoor meer botsingen worden vergemakkelijkt en oplost.
* Voorbeeld: Het schudden van een fles frisdrank helpt om meer koolstofdioxide op te lossen.
5. Laag molecuulgewicht van het gas:
* Verklaring: Gassen met lagere molecuulgewichten zijn meestal meer oplosbaar in vloeistoffen. Dit komt omdat ze minder intermoleculaire aantrekkingskracht hebben tussen hun moleculen, waardoor het voor hen gemakkelijker wordt om uit de gasfase te ontsnappen.
* Voorbeeld: Helium, een zeer licht gas, is minder oplosbaar in water dan zuurstof, een zwaarder gas.
6. Specifieke gas-vloeistof interacties:
* Verklaring: Sommige gas-vloeistofparen hebben unieke interacties die de oplosbaarheid kunnen beïnvloeden. Sommige gassen kunnen bijvoorbeeld zwakke bindingen vormen met vloeibare moleculen, waardoor ze meer oplosbaar zijn.
* Voorbeeld: Koolstofdioxide vormt koolzuur (H2CO3) in water, wat de oplosbaarheid ervan verhoogt.
Belangrijke opmerking: Deze factoren interageren met elkaar en hun gecombineerde effect bepaalt de algehele oplosbaarheid van een gas in een vloeistof.
 Er is te weinig bekend over natuurbrandrook
Er is te weinig bekend over natuurbrandrook 20 procent van de Amerikanen verantwoordelijk voor bijna de helft van de voedselgerelateerde broeikasgasemissies in de VS
20 procent van de Amerikanen verantwoordelijk voor bijna de helft van de voedselgerelateerde broeikasgasemissies in de VS Hoe wetenschap is belangrijk voor de mensheid?
Hoe wetenschap is belangrijk voor de mensheid?  CO2-sensornetwerk toont effecten metrogroei (Update)
CO2-sensornetwerk toont effecten metrogroei (Update) Met DISCO kunnen wetenschappers zeer reactief superoxide op koraalriffen meten
Met DISCO kunnen wetenschappers zeer reactief superoxide op koraalriffen meten
Hoofdlijnen
- Hoe bloedzuigende insecten donkergecoat vee in het donker vinden
- Wat omringt het celmembraan?
- Hoe kunnen mensen vleugels op natuurlijke wijze laten groeien?
- Fycologen ontdekken waardoor sommige bruine algen glinsteren en andere niet
- Wat als u balsemvloeistof dronk?
- Hoe eiwitreceptoren op cellen in- en uitschakelen
- Vechten of vluchten? Hoe vogels de mysteries van evolutie helpen onthullen
- Onderzoekers ontdekken hoe CRISPR-eiwitten hun doelwit vinden
- Ontdekking legt het immuunsysteem bloot
- Tussenlagen helpen perovskietkristallisatie voor hoogwaardige light-emitting diodes

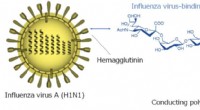
- Een bliksemsnelle griepvirusdetector
- Een natuurlijk geïnspireerde, herbruikbaar systeem dat water zuivert en zichzelf opbouwt

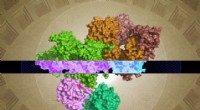
- Onderzoekers identificeren de moleculaire structuur van het GATOR1-eiwitcomplex dat cellulaire groeisignalen reguleert
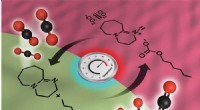
- Wetenschappers bevestigen verschillende regio's in het populaire oplosmiddel voor het opvangen en synthetiseren van koolstof
 Waarom zijn offshore-boringen zo controversieel?
Waarom zijn offshore-boringen zo controversieel?  Is het broeikaseffect de andere naam voor de opwarming van de aarde?
Is het broeikaseffect de andere naam voor de opwarming van de aarde?  Welke planeet heeft zijn jaren langer dan dag?
Welke planeet heeft zijn jaren langer dan dag?  Coöperatief creativiteitsexperiment onthult de meest efficiënte teamstructuren
Coöperatief creativiteitsexperiment onthult de meest efficiënte teamstructuren Gevriesdroogde aardbeien en ijs zorgen voor een zeer stabiele relatie
Gevriesdroogde aardbeien en ijs zorgen voor een zeer stabiele relatie Waarom is HI sterker zuur dan HCl?
Waarom is HI sterker zuur dan HCl?  Organische dunnefilmsensoren voor lichtbronanalyse en anti-namaaktoepassingen
Organische dunnefilmsensoren voor lichtbronanalyse en anti-namaaktoepassingen Hoe een 6e-graads zonnestelselmodelproject te maken
Hoe een 6e-graads zonnestelselmodelproject te maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

