
Wetenschap
Onderzoekers identificeren de moleculaire structuur van het GATOR1-eiwitcomplex dat cellulaire groeisignalen reguleert
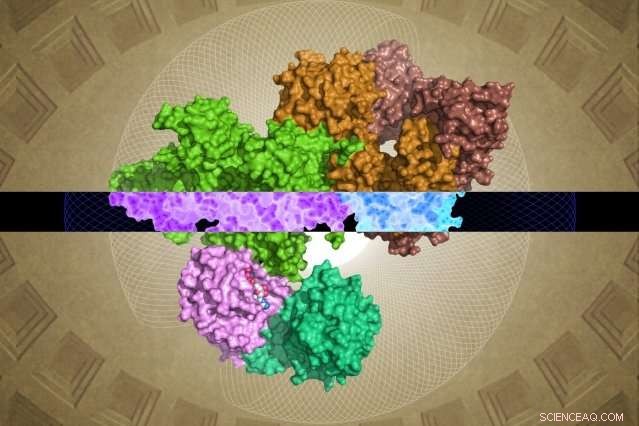
De door cryo-EM gegenereerde GATOR1-structuur kan inzicht geven in zijn functie. Krediet:Steven Lee/Whitehead Institute
Een team van onderzoekers van het Whitehead Institute en het Howard Hughes Medical Institute heeft de structuur onthuld van een belangrijk eiwitcomplex bij mensen dat signalen over nutriëntenniveaus doorgeeft. waardoor cellen hun groei kunnen afstemmen op de toevoer van materialen die nodig zijn om die groei te ondersteunen. Dit complexe, genaamd GATOR1, fungeert als een soort aan-uitschakelaar voor de "groei" (of "niet groei") signalen die door een kritieke cellulaire groeiroute stromen die bekend staat als mTORC1.
Ondanks het belang ervan, GATOR1 vertoont weinig gelijkenis met bekende eiwitten, waardoor er grote hiaten ontstaan in het begrip van wetenschappers van de moleculaire structuur en functie ervan. Nutsvoorzieningen, zoals online beschreven op 28 maart in het tijdschrift Natuur , Whitehead-wetenschappers en hun collega's hebben het eerste gedetailleerde moleculaire beeld van GATOR1 gegenereerd het onthullen van een zeer geordende groep eiwitten en een uiterst ongebruikelijke interactie met zijn partner, de Rag GTPase.
"Als je iets weet over de driedimensionale structuur van een eiwit, dan kun je weloverwogen gissingen doen over hoe het zou kunnen werken. Maar GATOR1 is eigenlijk een zwarte doos geweest, " zegt senior auteur David Sabatini, een lid van het Whitehead Institute, een professor in de biologie aan het MIT, en onderzoeker bij het Howard Hughes Medical Institute (HHMI). "Nutsvoorzieningen, Voor de eerste keer, we hebben afbeeldingen met hoge resolutie van GATOR1 gegenereerd en kunnen beginnen te ontleden hoe dit cruciale eiwitcomplex werkt."
GATOR1 werd ongeveer vijf jaar geleden voor het eerst geïdentificeerd. Het bestaat uit drie eiwitsubeenheden (Depdc5, Nprl2, en Nprl3), en mutaties in deze subeenheden zijn in verband gebracht met menselijke ziekten, waaronder kankers en neurologische aandoeningen zoals epilepsie. Echter, vanwege het gebrek aan gelijkenis met andere eiwitten, het grootste deel van het GATOR1-complex is een moleculair mysterie. "GATOR1 heeft geen goed gedefinieerde eiwitdomeinen, " legt Whitehead-onderzoeker Kuang Shen uit, een van de eerste auteurs van de studie. "Dus, dit complex is echt heel bijzonder en ook heel uitdagend om te bestuderen."
Vanwege de grote omvang en relatieve flexibiliteit van het complex, GATOR1 kan niet gemakkelijk worden gekristalliseerd - een noodzakelijke stap voor het oplossen van de eiwitstructuur via standaard, Röntgenkristallografische methoden. Als resultaat, Shen en Sabatini wendden zich tot Zhiheng Yu van HHMI. Yu en zijn team zijn gespecialiseerd in cryo-elektronenmicroscopie (cryo-EM), een opkomende techniek die veelbelovend is voor het visualiseren van de moleculaire structuren van grote eiwitten en eiwitcomplexen. belangrijk, het maakt geen gebruik van eiwitkristallen. In plaats daarvan, eiwitten worden snel ingevroren in een dunne laag verglaasd ijs en vervolgens afgebeeld door een bundel snelle elektronen in een elektronenmicroscoopkolom.
"Er zijn de afgelopen tien jaar enkele belangrijke vorderingen gemaakt in de cryo-EM-technologie, en nu, het is mogelijk om atomaire of bijna atomaire resolutie te bereiken voor een verscheidenheid aan eiwitten, " legt Yu uit, een senior auteur van het papier en directeur van HHMI's gedeeld, ultramoderne cryo-EM-faciliteit op Janelia Research Campus. De Nobelprijs voor scheikunde van vorig jaar werd toegekend aan drie wetenschappers voor hun baanbrekende inspanningen om cryo-EM te ontwikkelen.
GATOR1 bleek een lastig onderwerp, zelfs voor cryo-EM, en vergde wat vallen en opstaan van de kant van Yu, Shen, en hun collega's om monsters voor te bereiden die robuuste structurele informatie zouden kunnen opleveren. Bovendien, het werk van het team werd nog moeilijker gemaakt door de unieke vorm van het complex. Zonder enig idee van de potentiële structuur van GATOR1, Shen en zijn collega's, waaronder co-auteur Edward Brignole van MIT, moest het volledig van de grond af afleiden.
Hoe dan ook, het Whitehead-HHMI-team was in staat om bijna complete structuren op te lossen voor GATOR1 en voor GATOR1 gebonden aan zijn partnereiwitten, de Rag GTPases. (Twee regio's van de subeenheid Depdc5 zijn zeer flexibel en konden daarom niet worden opgelost.) Uit deze schat aan nieuwe informatie en uit de daaropvolgende biochemische analyses van het team, kwamen enkele verrassende bevindingen naar voren.
Ten eerste is er het opmerkelijke organisatieniveau van GATOR1. Het eiwit is buitengewoon goed georganiseerd, wat vrij ongebruikelijk is voor eiwitten die geen voorspelde structuren hebben. (Dergelijke eiwitten zijn meestal behoorlijk ongeorganiseerd.) de onderzoekers identificeerden vier eiwitdomeinen die nog nooit eerder in beeld waren gebracht. Deze nieuwe motieven, genaamd NTD, SABA, SHEN, en CTD - zou cruciale inzichten kunnen bieden in de innerlijke werking van het GATOR1-complex.
Shen, Sabatini, en hun collega's ontdekten nog een verrassing. In tegenstelling tot andere eiwitten die binden aan Rag GTPases, GATOR1 maakt op ten minste twee verschillende plaatsen contact met deze eiwitten. Bovendien, een van de bindingsplaatsen dient om de activiteit van de Rag GTPase te remmen - in plaats van te stimuleren. "Dit soort dubbele binding is nog nooit waargenomen - het is hoogst ongebruikelijk, "zegt Shen. De onderzoekers veronderstellen dat deze functie een van de redenen is waarom GATOR1 zo groot is - omdat het zijn Rag GTPase op meerdere locaties moet vasthouden, in plaats van één, zoals de meeste andere eiwitten van dit type doen.
Ondanks deze verrassingen, de onderzoekers erkennen dat hun analyses nog maar de oppervlakte van GATOR1 en de mechanismen waarmee het de mTOR-signaleringsroute reguleert, beginnen te krassen.
"Er is nog veel te ontdekken in dit eiwit, ' zegt Sabatini.
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Dupliceren of spiegelen? Laserlicht bepaalt chiraliteit van moleculen
Dupliceren of spiegelen? Laserlicht bepaalt chiraliteit van moleculen Baanbrekende ontdekkingen kunnen superieure legeringen creëren met veel toepassingen
Baanbrekende ontdekkingen kunnen superieure legeringen creëren met veel toepassingen Onderzoekers maken gepantserde emulsies als kleine reageerbuisjes voor parallelle reacties
Onderzoekers maken gepantserde emulsies als kleine reageerbuisjes voor parallelle reacties Gas omzetten in brandstoffen met betere legeringen
Gas omzetten in brandstoffen met betere legeringen Wijnpolyfenolen kunnen bacteriën afweren die gaatjes en tandvleesaandoeningen veroorzaken
Wijnpolyfenolen kunnen bacteriën afweren die gaatjes en tandvleesaandoeningen veroorzaken
 Hoe Earthships de wederopbouw in bosbrandgebieden veiliger kunnen maken
Hoe Earthships de wederopbouw in bosbrandgebieden veiliger kunnen maken Bewaarde pinguïnpoep onthult eerdere veranderingen in de circulatie in de Antarctische Oceaan
Bewaarde pinguïnpoep onthult eerdere veranderingen in de circulatie in de Antarctische Oceaan Vergelijking van het knelpunteffect en het oprichtereffect
Vergelijking van het knelpunteffect en het oprichtereffect  Digitale technologie:vriend of vijand tegen klimaatverandering?
Digitale technologie:vriend of vijand tegen klimaatverandering? Waarom hebben kleine veranderingen in de temperatuur op aarde een grote impact?
Waarom hebben kleine veranderingen in de temperatuur op aarde een grote impact?
Hoofdlijnen
- Insecten plagen met bitterzoete smaak om gewassen te beschermen
- BigH1 - de belangrijkste histon voor mannelijke vruchtbaarheid
- Wetenschappers controleren cellen met licht,
- Wat zijn de spoelen van DNA in de kern?
- Team publiceert onderzoek naar ongewone genevolutie in bacteriën
- Is het menselijk brein nog in ontwikkeling?
- Galapagos-studie toont aan dat nieuwe soorten zich in slechts twee generaties kunnen ontwikkelen
- Is er een verband tussen beweging en geluk?
- De methoden van inventarisatie in Microbes
- Mantis garnalen dactyl clubs kunnen geheimen bevatten voor meer veerkrachtige oppervlakken voor menselijk gebruik

- Anti-verouderingsmolecuul NAD+ krijgt een boost door het blokkeren van een enzym
- Recycling geeft nieuwe bestemming aan verbruikte splijtstof

- Natuurlijke pesticide op basis van silica beschermt gewassen in opslag en kan giftige fosfine elimineren

- Nieuwe connector voor duurzame constructies op aarde en in de ruimte

 Milieurisico's van muggenbestrijding met Bacillus thuringiensis israelensis (Bti)
Milieurisico's van muggenbestrijding met Bacillus thuringiensis israelensis (Bti) Groot buitenonderzoek toont aan dat biodiversiteit de stabiliteit van algenbiobrandstofsystemen verbetert
Groot buitenonderzoek toont aan dat biodiversiteit de stabiliteit van algenbiobrandstofsystemen verbetert Hubble onderzoekt de archeologie van de oude hub van onze Melkweg
Hubble onderzoekt de archeologie van de oude hub van onze Melkweg Persoonlijke veiligheid automatiseren met draagbare slimme sieraden
Persoonlijke veiligheid automatiseren met draagbare slimme sieraden Kleine bedrijven die eigendom zijn van Black en Latinx en liquide middelen
Kleine bedrijven die eigendom zijn van Black en Latinx en liquide middelen Onderzoek wijst uit dat het universum misschien wel 2 miljard jaar jonger is
Onderzoek wijst uit dat het universum misschien wel 2 miljard jaar jonger is Canadezen zeggen dat thuiswerken net zo productief is
Canadezen zeggen dat thuiswerken net zo productief is Iraanse hackers veroorzaakten honderden miljoenen verliezen:rapport
Iraanse hackers veroorzaakten honderden miljoenen verliezen:rapport
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Norway | Spanish | Danish |

-
Wetenschap © https://nl.scienceaq.com

