
Wetenschap
Welke vaste stoffen heeft waarschijnlijk het laagste smeltpunt?
* Type binding:
* ionische verbindingen: Over het algemeen hebben hoge smeltpunten vanwege een sterke elektrostatische aantrekkingskracht tussen ionen.
* Covalente verbindingen: Kan verschillende smeltpunten hebben. Netwerkcovalente vaste stoffen (zoals diamant) hebben zeer hoge smeltpunten, terwijl moleculaire vaste stoffen (zoals suiker) lagere smeltpunten hebben.
* metalen verbindingen: Over het algemeen hebben matige tot hoge smeltpunten, afhankelijk van de sterkte van de metalen binding.
* intermoleculaire krachten: Dit zijn de krachten tussen moleculen in moleculaire vaste stoffen. Sterkere intermoleculaire krachten (zoals waterstofbinding) leiden tot hogere smeltpunten.
* Moleculaire grootte en vorm: Grotere moleculen en die met meer complexe vormen hebben meestal hogere smeltpunten als gevolg van een verhoogd oppervlak voor interacties.
* Druk: Smeltpunt neemt toe met toenemende druk.
Bijvoorbeeld:
* natriumchloride (NaCl) is een ionische verbinding met een zeer hoog smeltpunt.
* ijs (H2O) is een moleculaire vaste stof met waterstofbinding, waardoor het een relatief hoog smeltpunt is voor een moleculaire vaste stof.
* helium (hij) is een edelgas met zeer zwakke interatomische krachten en een zeer laag smeltpunt.
Om u een definitief antwoord te geven, vertel me alsjeblieft de chemische formules of beschrijvingen van de vaste stoffen die je vergelijkt.
 Microplastics gevonden in oesters, mosselen aan de kust van Oregon, studie vondsten
Microplastics gevonden in oesters, mosselen aan de kust van Oregon, studie vondsten Waar de Jordaan stopt met stromen
Waar de Jordaan stopt met stromen Water in gesteente ondersteunt bomen in het hele land
Water in gesteente ondersteunt bomen in het hele land Amerikaanse democraten onthullen CO2-neutrale Green New Deal
Amerikaanse democraten onthullen CO2-neutrale Green New Deal Verbetering van de paleotemperatuur-reconstructie - Zwitserse meren als modelsysteem
Verbetering van de paleotemperatuur-reconstructie - Zwitserse meren als modelsysteem
Hoofdlijnen
- Een klimaatschurk? De impact van vlees op de planeet meten en beheren
- Hoe bacteriën worden gereproduceerd?
- Kun je me een voorbeeld geven van een onderzoekspersoon?
- Bio-engineered enzym creëert in één stap natuurlijke vanilline uit planten
- Wetenschappers zeggen dat een One Health-benadering van plantgezondheid van vitaal belang is voor het bereiken van duurzame wereldwijde voedselzekerheid
- Hoe maken wat diep waterbacteriën in de oceaan voedsel?
- Wat zijn de voorbeelden van positieve wetenschappen?
- Hoe slaapwandelen werkt
- Het orgaansysteem dat ondersteuning en bescherming biedt voor lichaamsdelen is het endocriene of circulatoire skeletale ademhalingssysteem?
- Onderzoekers helpen bij het ontwikkelen van duurzame polymeren

- Op weg naar platina:een niet-giftige katalysator voor schoon, herbruikbaar water

- Video:Hoe werkt airconditioning?

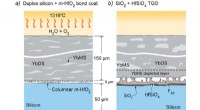
- Materiaal en coatingproces om keramische onderdelen te beschermen
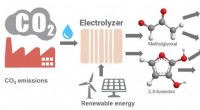
- Hoe klimaatveranderende koolstofdioxide om te zetten in plastic en andere producten?
 Franse demonstranten blokkeren Amazon-sites vanwege klimaat, banen
Franse demonstranten blokkeren Amazon-sites vanwege klimaat, banen Een nieuw facet van brandstofcelchemie
Een nieuw facet van brandstofcelchemie Wat meet de lichtsterkte van een lamp?
Wat meet de lichtsterkte van een lamp?  Wat betekent dat alle atomen nuetraal zijn?
Wat betekent dat alle atomen nuetraal zijn?  Is LM-7 Waterman nog steeds in een baan om de aarde?
Is LM-7 Waterman nog steeds in een baan om de aarde?  Klimaatverandering heeft gevolgen voor terroristische activiteiten, zo blijkt uit onderzoek
Klimaatverandering heeft gevolgen voor terroristische activiteiten, zo blijkt uit onderzoek  Weerbestendige chip is bedoeld om zelfrijdende technologie te gebruiken, draadloze communicatie naar het volgende niveau
Weerbestendige chip is bedoeld om zelfrijdende technologie te gebruiken, draadloze communicatie naar het volgende niveau Kunstmatige enzymen zetten zonne-energie om in waterstofgas
Kunstmatige enzymen zetten zonne-energie om in waterstofgas
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

