
Wetenschap
Hoe kan water een neutraal molecuul zijn, maar er nog steeds positieve en negatieve opladers op hebben?
1. Polariteit:
* Water is een polair molecuul. Dit betekent dat de elektronen in het molecuul niet gelijk worden gedeeld tussen de zuurstof- en waterstofatomen. Het zuurstofatoom is meer elektronegatief (trekt elektronen sterker aan) dan de waterstofatomen.
* Als gevolg hiervan heeft het zuurstofatoom een enigszins negatieve lading (Δ-) en hebben de waterstofatomen enigszins positieve ladingen (δ+). Deze ongelijke ladingsverdeling creëert een dipoolmoment in het watermolecuul.
2. Algemene neutraliteit:
* Hoewel het zuurstofatoom een negatieve lading heeft en de waterstofatomen positieve ladingen hebben, is het totale molecuul neutraal. De positieve en negatieve ladingen binnen het molecuul annuleren elkaar.
3. Waterstofbinding:
* De positieve en negatieve ladingen op watermoleculen stellen hen in staat om waterstofbindingen te vormen met elkaar. De enigszins positieve waterstofatomen van het ene watermolecuul worden aangetrokken door het enigszins negatieve zuurstofatoom van een ander watermolecuul. Deze sterke aantrekkingskracht is wat water veel van zijn unieke eigenschappen geeft, zoals zijn hoge kookpunt en het vermogen om veel stoffen op te lossen.
Samenvattend:
Water is een polair molecuul met een enigszins negatieve lading op het zuurstofatoom en enigszins positieve ladingen op de waterstofatomen. Het molecuul als geheel is echter neutraal omdat deze ladingen in evenwicht zijn. Met deze polariteit kunnen watermoleculen waterstofbruggen vormen, die belangrijk zijn voor de vele eigenschappen.
 Wat is de oppervlaktedruk op kwik?
Wat is de oppervlaktedruk op kwik?  Welke doeleinden worden kolen vaak gebruikt?
Welke doeleinden worden kolen vaak gebruikt?  Wat is het grensgetal voor het verschil in elektronegatief om te bepalen of een binding ionisch of covalent is?
Wat is het grensgetal voor het verschil in elektronegatief om te bepalen of een binding ionisch of covalent is?  Wat is de naam van het ion in de ammoniakoplossing dat pH 10 veroorzaakt?
Wat is de naam van het ion in de ammoniakoplossing dat pH 10 veroorzaakt?  Ontwikkeling van multifunctionele composietmaterialen voor ruimtevaarttoepassingen
Ontwikkeling van multifunctionele composietmaterialen voor ruimtevaarttoepassingen
 Roze ijs in Italiaanse Alpen veroorzaakt algensonde
Roze ijs in Italiaanse Alpen veroorzaakt algensonde Voorspellingen verifiëren voor grote plotselinge opwarming in de stratosfeer
Voorspellingen verifiëren voor grote plotselinge opwarming in de stratosfeer Is de wetenschap werkelijk beter in zelfcorrectie dan de journalistiek?
Is de wetenschap werkelijk beter in zelfcorrectie dan de journalistiek?  Pure angst:Louisiana zet zich schrap voor orkaandelta
Pure angst:Louisiana zet zich schrap voor orkaandelta Zo snel terug, La Niña? Dit is waarom we twee doorweekte zomers op rij kregen
Zo snel terug, La Niña? Dit is waarom we twee doorweekte zomers op rij kregen
Hoofdlijnen
- Overeenkomsten van mitose en meiose
- Hoe transcriptiefactoren clusters van specifieke DNA-sequenties vinden en herkennen
- Leg uit waarom grote actieve organismen een speciaal oppervlak nodig hebben voor uitwisseling?
- In een reservoir in Zuidoost-Brazilië heeft de introductie van een vis afkomstig uit het Amazonegebied de diversiteit van de inheemse soorten verminderd
- Een leider in de Amerikaanse zeewierteelt predikt, onderwijst en bouwt een breder netwerk op
- Hoe neuronale herkenning van zangvogelgeluiden zich in de loop van de tijd ontvouwt
- Wat is een dorsaal op zeesterren?
- Weten wat je moet bewaren en weggooien:hoe een enzym cellulaire berichten onderscheidt
- Wat is de stapel membranen in chloroplast?
- Techniek om functionele materialen te maken op basis van polymeren van metaalclusters
- Chemicus legt de wetenschap achter vuurwerk uit

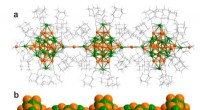
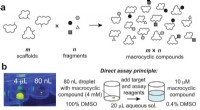
- Grote aantallen macrocyclische verbindingen die nodig zijn voor de ontwikkeling van medicijnen tegen moeilijke ziektedoelen gesynthetiseerd
- Licht vangen:hoe kobalt kan helpen zichtbaar licht te gebruiken om waterstofproductie uit water aan te drijven

- Onderzoekers ontdekken verborgen ontijzingsrisico's die de gezondheid van de brug beïnvloeden

 Gear behandeld met forever chemicaliën vormt een risico voor brandweerlieden
Gear behandeld met forever chemicaliën vormt een risico voor brandweerlieden Rotsen verbrijzelen
Rotsen verbrijzelen Orkanen en andere rampen met extreem weer zetten sommige mensen ertoe aan te verhuizen en anderen op hun plaats te houden
Orkanen en andere rampen met extreem weer zetten sommige mensen ertoe aan te verhuizen en anderen op hun plaats te houden Grote wind- en zonneparken in de Sahara zouden de warmte verhogen, regenen, vegetatie
Grote wind- en zonneparken in de Sahara zouden de warmte verhogen, regenen, vegetatie Wetenschappers noemen destructieve gevaren van klimaatverandering, landgebruik in bergketens
Wetenschappers noemen destructieve gevaren van klimaatverandering, landgebruik in bergketens Hoe fluctuerende zuurstofniveaus de evolutie van dieren kunnen hebben versneld
Hoe fluctuerende zuurstofniveaus de evolutie van dieren kunnen hebben versneld  Stroomuitval:ingenieurs maken een draadloze oplader die je gemakkelijk in vorm kunt knippen
Stroomuitval:ingenieurs maken een draadloze oplader die je gemakkelijk in vorm kunt knippen Werken aan een snelle en zachte diagnose van borstkanker
Werken aan een snelle en zachte diagnose van borstkanker
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

