
Wetenschap
Bereken het werk dat is gedaan wanneer 1,0 mol water bij 273 K tegen als atmosferische druk atmosfeer verdampt. Ga uit van ideaal gasgedrag.?
Inzicht in de concepten
* verdamping: Dit is het proces van een vloeistof die in een gas verandert.
* werk gedaan: In de thermodynamica is werk dat door een systeem wordt uitgevoerd de energie die door het systeem wordt overgedragen vanwege een volumeverandering. Voor een ideaal gas wordt dit berekend als:
* W =-pAV (waarbij p druk is en ΔV de verandering in volume is)
* Ideale gaswet: PV =NRT (waarbij P druk is, V is volume, n is mol, r is de ideale gasconstante en t is temperatuur)
Berekeningen
1. Bepaal het initiële volume:
* Omdat water een vloeistof is, kunnen we het initiële volume negeren.
2. Bepaal het uiteindelijke volume (volume waterdamp):
* Gebruik de ideale gaswet om het volume van 1 mol waterdamp te vinden bij 273 K en 1 atm druk.
* V =(nrt)/p =(1 mol * 0,0821 l · atm/mol · k * 273 k)/1 atm ≈ 22.4 l
3. Bereken de volumeverandering:
* ΔV =uiteindelijke volume - initiële volume ≈ 22,4 l - 0 l =22,4 l
4. Bereken werk gedaan:
* W =-pAV =-(1 atm) * (22,4 l) ≈ -22.4 l · atm
Conversie naar Joules
* 1 L · ATM =101.325 J
* Daarom W ≈ -22.4 L · ATM * 101.325 J/L · ATM ≈ -2270 J
Belangrijke opmerking: Deze berekening veronderstelt dat het verdampingsproces optreedt bij constante druk (isobaar).
Conclusie
Het werk dat wordt gedaan wanneer 1 mol water tegen atmosferische druk bij 273 K verdampt, is ongeveer -2270 J. Het negatieve teken geeft aan dat werk wordt gedaan * door * het systeem (de waterdamp) op de omgeving (de atmosfeer).
 Is suiker een reactant of product?
Is suiker een reactant of product?  Waarom zijn de halogenen zo reactief en edelgassen niet reactief?
Waarom zijn de halogenen zo reactief en edelgassen niet reactief?  Bestaat er een chemische formule voor ammoniak en chloor?
Bestaat er een chemische formule voor ammoniak en chloor?  Chemische synthese zou krachtigere antibiotica kunnen produceren
Chemische synthese zou krachtigere antibiotica kunnen produceren Welke soort reactanten worden gebruikt bij het maken van plastic explosieven?
Welke soort reactanten worden gebruikt bij het maken van plastic explosieven?
 Wat is een lijst van zoogdieren met zakjes?
Wat is een lijst van zoogdieren met zakjes?  NASA kijkt naar zware regenval in tropische storm Barbara
NASA kijkt naar zware regenval in tropische storm Barbara Studie zegt dat door China gesteunde dam Mekong . zou vernietigen
Studie zegt dat door China gesteunde dam Mekong . zou vernietigen Dataproject beoordeelt hoe goed landen over de hele wereld de mensenrechten beschermen
Dataproject beoordeelt hoe goed landen over de hele wereld de mensenrechten beschermen  Kan een verenigd pad voor ontwikkeling en behoud leiden tot een betere toekomst?
Kan een verenigd pad voor ontwikkeling en behoud leiden tot een betere toekomst?
Hoofdlijnen
- Wat zijn enkele vragen die niet door wetenschappers kunnen worden beantwoord?
- Internationaal onderzoek levert een uitgebreide levensboom op voor bloeiende planten
- Kan tapioca maïs vervangen als belangrijkste bron voor zetmeelzoetstoffen?
- Genen die mensen scheiden van fruitvliegen gevonden
- Wetenschappers hebben een appeltje te schillen met paleontologie in videogames
- Gel elektroforese lezen
- Wat is mutualisme van een pinguïn?
- Hoe werkt het endocriene systeem samen met de bloedsomloop?
- Waarom virussen zoals Herpes en Zika opnieuw moeten worden geclassificeerd, de biotech-impact ervan
- Onderzoek naar schoner, efficiëntere productie van bio-energie met neutronen

- Ingenieurs bouwen chemisch aangedreven wielen die veranderen in tandwielen om mechanisch werk uit te voeren

- Onderzoekers maken nieuw laagsmeltend, stikstofhoudend, tinachtig chloorfosfaatglas

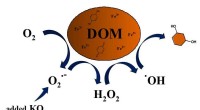
- Superoxide produceert hydroxylradicalen die opgeloste organische stoffen in water afbreken
- Chemische beeldvorming met groot oppervlak onthult originele verflagen op Lam Gods

 Hoe kan een biologisch systeem worden beïnvloed door een verandering in pH-waarden?
Hoe kan een biologisch systeem worden beïnvloed door een verandering in pH-waarden?  Hoe het vliegtuig zal werken
Hoe het vliegtuig zal werken  Wetenschappers ontdekken dat de Galapagos-vulkaan toekomstige uitbarstingen kan voorspellen
Wetenschappers ontdekken dat de Galapagos-vulkaan toekomstige uitbarstingen kan voorspellen Superkristallen met nieuwe architectuur kunnen de synthese van geneesmiddelen verbeteren
Superkristallen met nieuwe architectuur kunnen de synthese van geneesmiddelen verbeteren Onderzoekers kapen zonneceltechnologie om een eenvoudige spuittest voor lood te ontwikkelen
Onderzoekers kapen zonneceltechnologie om een eenvoudige spuittest voor lood te ontwikkelen  Observatorium in Chili neemt metingen met de hoogste resolutie van oppervlaktetemperaturen van asteroïden die ooit op aarde zijn verkregen
Observatorium in Chili neemt metingen met de hoogste resolutie van oppervlaktetemperaturen van asteroïden die ooit op aarde zijn verkregen Geowetenschappers vergelijken micro-organismen in de poolgebieden
Geowetenschappers vergelijken micro-organismen in de poolgebieden Experiment laat zien dat groepen leken verhalen net zo goed beoordelen als factcheckers
Experiment laat zien dat groepen leken verhalen net zo goed beoordelen als factcheckers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

