
Wetenschap
Waarom is berylliumoxide amfoterisch van aard?
1. Klein formaat en hoge ladingsdichtheid van beryllium:
- Beryllium is een zeer klein atoom met een hoge positieve ladingsdichtheid.
- Dit leidt tot een sterk polarisatiekracht, wat betekent dat het de elektronenwolk van andere atomen kan vervormen, waardoor het waarschijnlijker is om zowel zure als basisverbindingen te vormen.
2. Covalent karakter van Beo:
- De binding in BEO heeft een significant covalent karakter vanwege de kleine omvang van zowel beryllium als zuurstof.
- Dit covalente karakter stelt Beo in staat om zowel een zuur als een basis te werken.
3. Mogelijkheid om te reageren met zowel zuren als basen:
- met zuren: Beo reageert met zuren om zouten en water te vormen, als een basis. Bijvoorbeeld:
`` `
Beo + 2hcl → BECL2 + H2O
`` `
- met bases: Beo reageert met sterke basen zoals NaOH om beryles te vormen, die als een zuur fungeren. Bijvoorbeeld:
`` `
Beo + 2naoh → na2beo2 + h2o
`` `
4. Vorming van zowel berylliumzouten als Beryles:
- Het vermogen van beo om te reageren met zowel zuren als basen leidt tot de vorming van zowel berylliumzouten (zoals Becl2) als beryllates (zoals Na2BeO2), wat verder de amfoterische aard ervan aantoont.
Samenvattend maakt de combinatie van Beryllium's kleine grootte, hoge ladingsdichtheid, covalente karakter van Beo en het vermogen om te reageren met zowel zuren als basen maakt het een amfoterisch oxide.
 Hoe vind je het evenwichtsconstante met behulp van standaardreductiepotentialen?
Hoe vind je het evenwichtsconstante met behulp van standaardreductiepotentialen?  Hoeveel chloride-ionen zijn er aanwezig in een formule-eenheid magnesium, gegeven de lading op mg ion 2 plus is?
Hoeveel chloride-ionen zijn er aanwezig in een formule-eenheid magnesium, gegeven de lading op mg ion 2 plus is?  Welk bewijs heb je waargenomen dat zou doen geloven dat het residu kaliumchloride was?
Welk bewijs heb je waargenomen dat zou doen geloven dat het residu kaliumchloride was?  Elementen in planten gebruiken om de efficiëntie van de brandstofcel te verhogen en tegelijkertijd de kosten te verlagen
Elementen in planten gebruiken om de efficiëntie van de brandstofcel te verhogen en tegelijkertijd de kosten te verlagen Is een vorkgeleider of isolator?
Is een vorkgeleider of isolator?
 Hoe een zelfonderhoudend ecosysteem te maken
Hoe een zelfonderhoudend ecosysteem te maken  Voedselresten worden zuivel- en vleesvervangers
Voedselresten worden zuivel- en vleesvervangers Toename van stormen kan catastrofale gevolgen hebben voor de visserijsector
Toename van stormen kan catastrofale gevolgen hebben voor de visserijsector Wat is de Green New Deal precies (en zou u dit moeten ondersteunen?)
Wat is de Green New Deal precies (en zou u dit moeten ondersteunen?)  NASA analyseert waterdampconcentratie van tropische cycloon Herolds
NASA analyseert waterdampconcentratie van tropische cycloon Herolds
Hoofdlijnen
- Biologen onderzoeken hoe testaatamoeben overleven bij turfbranden
- Trappers vragen rechtbank om rechtszaak over Amerikaanse bontexport weg te gooien
- Wat transporteert vaste deeltjes in een cel?
- Mariene wetenschappers bepalen hoe de larven van een veel voorkomende koraalsoort reageren op omgevingsstress
- Welk proces gebruikt wetenschappers om vragen over de wereld te beantwoorden?
- Welke voorwaarden genereren nieuwe soorten?
- Moleculair mechanisme van CmoDREB2A en CmoNAC1 in pompoen dat de zouttolerantie van geënte komkommer reguleert onthuld
- Milieu op basis van evolutie indelen in twee categorieën?
- De wilde ezel keert terug
- Zachte en ionengeleidende kunsttong van hydrogel voor astringentieperceptie

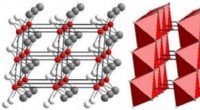
- Minerale ontdekking gemakkelijker gemaakt:röntgentechniek werpt een nieuw licht op kleine, zeldzame kristallen
- Onderzoek leidt toekomst van plastic afval chemische recycling

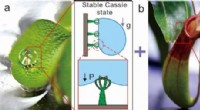
- Een nieuw salvinia-achtig glad oppervlak
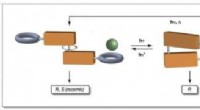
- Een moleculaire motor gebruiken om de voorkeur van anionbindende katalysatoren te veranderen
 Hoe de evolutie de optimale botstructuur bij springende knaagdieren voorbijschoot
Hoe de evolutie de optimale botstructuur bij springende knaagdieren voorbijschoot Vrouwelijke basketbalspelers worden geconfronteerd met onevenredige raciale vooroordelen:nieuwe studie
Vrouwelijke basketbalspelers worden geconfronteerd met onevenredige raciale vooroordelen:nieuwe studie Hoe ziet versteende hout eruit?
Hoe ziet versteende hout eruit?  Onderzoekers ontwikkelen de volgende generatie endoscopietechnologie
Onderzoekers ontwikkelen de volgende generatie endoscopietechnologie Paradigmaverschuiving nodig voor ontwerpen tsunami-resistente bruggen
Paradigmaverschuiving nodig voor ontwerpen tsunami-resistente bruggen Detectortechnologie levert ongekende 3D-beelden op, kondigt een veel grotere toepassing aan om neutrino's te bestuderen
Detectortechnologie levert ongekende 3D-beelden op, kondigt een veel grotere toepassing aan om neutrino's te bestuderen MRI-techniek detecteert de eigenschappen van verpakt vlees
MRI-techniek detecteert de eigenschappen van verpakt vlees NASA kijkt naar tropische cyclonen Irwin en Hilary regenval en Fujiwara-effect
NASA kijkt naar tropische cyclonen Irwin en Hilary regenval en Fujiwara-effect
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

