
Wetenschap
Hoe worden eiwitten gedenatureerd in een organisch oplosmiddel?
1. Verstoring van hydrofobe interacties:
* Eiwitten worden gevouwen in een waterige omgeving, met hydrofobe aminozuurresiduen in de eiwitkern.
* Organische oplosmiddelen zijn typisch niet-polair en verstoren deze hydrofobe interacties, waardoor de hydrofobe residuen worden gedwongen om te interageren met het oplosmiddel.
* Dit verstoort de gevouwen structuur van het eiwit, wat leidt tot ontvouwen en denaturatie.
2. Verstoring van waterstofbruggen:
* Waterstofbindingen spelen een cruciale rol bij het handhaven van de secundaire en tertiaire structuren van eiwitten.
* Organische oplosmiddelen, vooral die met hoge diëlektrische constanten, kunnen interfereren met waterstofbinding door te concurreren om waterstofbindingsdonoren en acceptoren.
* Dit verstoort het netwerk van waterstofbindingen in het eiwit, wat leidt tot ontvouwen.
3. Wijziging van ladingsverdeling:
* Organische oplosmiddelen kunnen de ladingsverdeling op het eiwitoppervlak veranderen door de diëlektrische constante van de omringende omgeving te veranderen.
* Dit kan elektrostatische interacties tussen aminozuurresiduen verstoren, wat bijdraagt aan denaturatie.
4. Solvatie van niet-polaire residuen:
* Organische oplosmiddelen kunnen niet-polaire residuen op het eiwitoppervlak oplossen, waardoor de hydrofobe interacties worden verstoord die de eiwitstructuur stabiliseren.
* Dit kan leiden tot ontvouwing en aggregatie van het eiwit.
5. Veranderingen in wateractiviteit:
* Organische oplosmiddelen kunnen de wateractiviteit in de omgeving verminderen, wat de eiwitstructuur en stabiliteit kan beïnvloeden.
* Dit kan uitdroging van het eiwit bevorderen en zijn hydratatieschaal verstoren, wat bijdraagt aan denaturatie.
Specifieke voorbeelden:
* ethanol: Ethanol is een relatief polair oplosmiddel dat waterstofbruggen kan verstoren en ladingsverdelingen kan veranderen. Het wordt vaak gebruikt in ontsmettingsmiddelen en alcoholdoekjes.
* aceton: Aceton is een zeer niet-polair oplosmiddel dat hydrofobe interacties verstoort en niet-polaire residuen kan oplossen.
* chloroform: Chloroform is een niet-polair oplosmiddel dat lipiden kan oplossen en eiwitstructuur kan verstoren.
factoren die de denaturatie beïnvloeden:
* Type oplosmiddel: De polariteit en diëlektrische constante van het organische oplosmiddel spelen een cruciale rol in denaturatie.
* Oplosmiddelconcentratie: Hogere concentraties van organische oplosmiddelen leiden in het algemeen tot grotere denaturatie.
* Temperatuur: Verhoogde temperatuur kan de denaturatie in organische oplosmiddelen verbeteren.
* eiwitstructuur: De stabiliteit en structuur van het eiwit zelf kan de gevoeligheid voor denaturatie beïnvloeden.
Opmerking: Denaturatie in organische oplosmiddelen kan in veel gevallen onomkeerbaar zijn, wat leidt tot permanent verlies van eiwitfunctie.
 Wat betekent klimaatverandering voor extreme golven? In 80% van de wereld weten we het niet echt
Wat betekent klimaatverandering voor extreme golven? In 80% van de wereld weten we het niet echt  Klimaatverandering zal naar verwachting voortijdige sterfgevallen door luchtvervuiling doen toenemen
Klimaatverandering zal naar verwachting voortijdige sterfgevallen door luchtvervuiling doen toenemen Duitsland bereikt akkoord over CO2-prijsbepaling na slopend debat
Duitsland bereikt akkoord over CO2-prijsbepaling na slopend debat Monitoring van CO2-lekkagelocaties op de oceaanbodem
Monitoring van CO2-lekkagelocaties op de oceaanbodem Recycling van plastic flessen Carbios haalt donateurs op
Recycling van plastic flessen Carbios haalt donateurs op
Hoofdlijnen
- Waarom stinkt de stinkplant?
- Wat zijn enkele nadelen en voordelen om parasiet te zijn?
- Wie was de eerste elektrochemische cel uitgevonden?
- Vorm of functie? Evolutie volgt verschillende paden
- Hoe herhaalbaar is de evolutionaire geschiedenis?
- Wat is het voorbeeld van ongewenste bacteriën?
- Westerse steden proberen te voorkomen dat hongerige beren ravage aanrichten
- Genetische aanpassingen hebben de bloedsamenstelling van twee populaties uit Papoea-Nieuw-Guinea beïnvloed, blijkt uit onderzoek
- Waarom dieren hun eigen geslacht het hof maken
- Chemici weerleggen de universele aard van de kwiktest
- Verbetering van methoden voor het afleveren van genen

- Chemici maken cellulaire krachten zichtbaar op moleculaire schaal
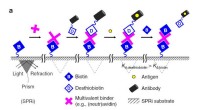
- Gewoon een molecuul naar een biomolecuul klikken voor een andere functie
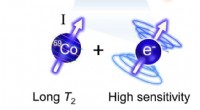
- Chemici ontwerpen chemische sonde voor het detecteren van minieme temperatuurverschuivingen in het lichaam
 Schaduwnetwerk beschermt gemeenschappen tegen dodelijke vulkaan
Schaduwnetwerk beschermt gemeenschappen tegen dodelijke vulkaan Haat annuleren cultuur? Geef algoritmen de schuld
Haat annuleren cultuur? Geef algoritmen de schuld Onderzoekers brengen regio's in kaart waar exoplaneten kunnen bestaan binnen drievoudige stersystemen
Onderzoekers brengen regio's in kaart waar exoplaneten kunnen bestaan binnen drievoudige stersystemen Rapport over seismische contextmetingen voor geïnduceerde seismiciteit
Rapport over seismische contextmetingen voor geïnduceerde seismiciteit DNA-origami bundelt krachten met moleculaire motoren om machines op nanoschaal te bouwen
DNA-origami bundelt krachten met moleculaire motoren om machines op nanoschaal te bouwen NASA ziet overblijfselen van ex-tropische cycloon Beryls vechten om te overleven
NASA ziet overblijfselen van ex-tropische cycloon Beryls vechten om te overleven Warme lucht hielp het ozongat in 2017 het kleinst te maken sinds 1988
Warme lucht hielp het ozongat in 2017 het kleinst te maken sinds 1988 Waarom blijven ijzer en staal aan magneten?
Waarom blijven ijzer en staal aan magneten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

