
Wetenschap
Wat is geen veronderstelling over deeltjes in een gas volgens de kinetische theorie?
Veronderstellingen van de kinetische gassen:
1. Deeltjes zijn in constante, willekeurige beweging: Gasdeeltjes bewegen in alle richtingen met een reeks snelheden, botsen met elkaar en de wanden van hun container.
2. Verwaarloosbaar volume deeltjes: In vergelijking met het volume van de container wordt het volume van de afzonderlijke gasdeeltjes als onbeduidend beschouwd.
3. Elastische botsingen: Wanneer deeltjes botsen, gaat er geen energie verloren door wrijving of andere factoren. Kinetische energie wordt overgedragen tussen deeltjes.
4. Geen intermoleculaire krachten: Gasdeeltjes worden verondersteld verwaarloosbare aantrekkingskracht of afstoting tussen hen te hebben.
5. Gemiddelde kinetische energie is evenredig met de temperatuur: De gemiddelde kinetische energie van gasdeeltjes is recht evenredig met de absolute temperatuur van het gas.
de niet-aansluiting:
De kinetische theorie gaat er niet vanuit dat alle deeltjes dezelfde snelheid hebben. In werkelijkheid hebben de deeltjes een verdeling van snelheden. Sommigen bewegen sneller, sommige gaan langzamer en de gemiddelde snelheid is gerelateerd aan de temperatuur.
Sleutelpunt: Hoewel de kinetische theorie het gedrag van gassen vereenvoudigt, biedt het een krachtig kader voor het begrijpen van gaseigenschappen.
 Vooruitgang van elektrolyse bij hoge temperatuur:water splitsen om energie op te slaan als waterstof
Vooruitgang van elektrolyse bij hoge temperatuur:water splitsen om energie op te slaan als waterstof Wat is de naam van koolstofdioxidegastest?
Wat is de naam van koolstofdioxidegastest?  Sommige kristallen worden gevormd uit hete gesmolten rots genaamd?
Sommige kristallen worden gevormd uit hete gesmolten rots genaamd?  Wetenschappers vinden goedkopere manier om waterstof uit water te maken
Wetenschappers vinden goedkopere manier om waterstof uit water te maken Welk uitscheidingsorgaan verwijdert zout?
Welk uitscheidingsorgaan verwijdert zout?
 Aardbeving treft het Indonesische eiland Bali, maar geen slachtoffers
Aardbeving treft het Indonesische eiland Bali, maar geen slachtoffers De zandvanger:de vraag overtreft voorzichtigheid - en kennis
De zandvanger:de vraag overtreft voorzichtigheid - en kennis Ongewenst record:grootste dode zone ooit in Golf van Mexico
Ongewenst record:grootste dode zone ooit in Golf van Mexico Vloeipunten:een nieuwe methode voor het beheer van watervoorraden in bossen
Vloeipunten:een nieuwe methode voor het beheer van watervoorraden in bossen  Jaarindex onthult grootste stijgers in aanpassing aan klimaatverandering
Jaarindex onthult grootste stijgers in aanpassing aan klimaatverandering
Hoofdlijnen
- Waarom is een microscoop belangrijk?
- Veren hebben hun eigen geuren, en roofdieren weten het
- Nieuwe studie werpt licht op de rol van de zon bij het verminderen van schimmelziekte van mangofruit
- Kunnen windturbines en trekvogels naast elkaar bestaan?
- Wat is de wetenschappelijke naam van Curacao Apple?
- Waar verwijst de afkorting SCI naar?
- Soorten lijken bedrieglijk veerkrachtig tegen klimaatverandering
- Wat is een wetenschappelijke sleutel?
- Wetenschappers ontdekken patronen van olifantenstroperij in Oost-Afrika
- Onderzoek onthult een nieuwe manier om chirale katalysatoren te maken

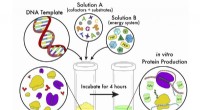
- Vereenvoudigde methode maakt celvrije eiwitsynthese flexibeler en toegankelijker
- Ontdekking van hoe amyloïden metaalionen binden werpt licht op de eiwitfunctie
- Biochemische netwerken in kaart gebracht in de middendarm van Aedes aegypti-muggen

- Superieure waterstofkatalysator groeit gewoon zo

 Bereken de hoeveelheid ammoniak die wordt geproduceerd uit 50 g N in vergelijking N2+3H2=2NH3?
Bereken de hoeveelheid ammoniak die wordt geproduceerd uit 50 g N in vergelijking N2+3H2=2NH3?  Gegevenssonificatie:geluiden uit de hele Melkweg
Gegevenssonificatie:geluiden uit de hele Melkweg Wat zijn de chemische formules voor marmer?
Wat zijn de chemische formules voor marmer?  Waarom is de innerlijke kern van de aarde zo dik?
Waarom is de innerlijke kern van de aarde zo dik?  Video:Bijen leiden de weg naar de toekomst van de landbouw
Video:Bijen leiden de weg naar de toekomst van de landbouw Door de uitstoot te verminderen, richt de Noord-Atlantische Oceaan zich op de opname van oceaanwarmte onder de opwarming van de aarde
Door de uitstoot te verminderen, richt de Noord-Atlantische Oceaan zich op de opname van oceaanwarmte onder de opwarming van de aarde Organische elektronica – hoe je contact kunt maken tussen koolstofverbindingen en metaal
Organische elektronica – hoe je contact kunt maken tussen koolstofverbindingen en metaal  Astronomen onderzoeken een ongewoon massief gasrijk sterrenstelsel
Astronomen onderzoeken een ongewoon massief gasrijk sterrenstelsel
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

