
Wetenschap
Wat is de atomaire radii -grootte voor alkali -metalen?
* Verhogende aantal elektronenschalen: Terwijl u het periodiek systeem afneemt, heeft elk alkalimetaal nog een elektronenschaal dan het hierboven. Deze schelpen bevinden zich verder van de kern, wat leidt tot een grotere atoomradius.
* Afschermingseffect: De binnenste elektronenschalen beschermen het buitenste valentie -elektron tegen de volledige aantrekkelijke kracht van de kern. Naarmate het aantal elektronenschillen toeneemt, wordt het afschermingseffect sterker, waardoor het buitenste elektron minder strak gebonden is en verder weg van de kern.
* Zwakke effectieve nucleaire lading: De alkali -metalen hebben slechts één valentie -elektron, wat betekent dat de effectieve nucleaire lading (de netto positieve lading door het valentie -elektron) relatief zwak is. Hierdoor kan het valentie -elektron verder weg van de kern zijn, wat bijdraagt aan een grotere atoomradius.
Hier is een algemene trend:
* lithium (li): 167 uur
* natrium (NA): 186 uur
* kalium (k): 231 uur
* rubidium (RB): 247 uur
* cesium (CS): 265 uur
* Francium (FR): 270 PM (geschat)
Belangrijke opmerking: Atomische stralen kunnen op verschillende manieren worden gemeten, wat leidt tot enigszins verschillende waarden. De bovenstaande waarden zijn benaderd en kunnen variëren, afhankelijk van de gebruikte methode.
 Kan carbonzuur reageren met Grignard-reagens?
Kan carbonzuur reageren met Grignard-reagens?  Wat is gebruikelijk tussen 1 mol Ag en Au?
Wat is gebruikelijk tussen 1 mol Ag en Au?  Wat is de dichtheid van grafeenoxide of grafeen?
Wat is de dichtheid van grafeenoxide of grafeen?  Waarom veranderen bindingen van vorm wanneer de temperatuur wordt verhoogd?
Waarom veranderen bindingen van vorm wanneer de temperatuur wordt verhoogd?  Wetenschappers ontwikkelen een effectieve aanpak voor het optimaliseren van medicinale moleculen
Wetenschappers ontwikkelen een effectieve aanpak voor het optimaliseren van medicinale moleculen
 Bestrijding van 18 branden, Californië kan het ergste brandseizoen tegemoet gaan
Bestrijding van 18 branden, Californië kan het ergste brandseizoen tegemoet gaan Een essentiële leemte in klimaatmodellen opvullen
Een essentiële leemte in klimaatmodellen opvullen Trump wil verbod op boren in het Noordpoolgebied opheffen
Trump wil verbod op boren in het Noordpoolgebied opheffen Compilatie van onderzoek naar PFAS in het milieu
Compilatie van onderzoek naar PFAS in het milieu Warme wind in de herfst kan de Larsen C-ijsplaat van Antarctica onder druk zetten
Warme wind in de herfst kan de Larsen C-ijsplaat van Antarctica onder druk zetten
Hoofdlijnen
- Wat is de relatie tussen biologie en economische ontwikkeling?
- Ziek van de Mexicaanse griep? Giftige algen kunnen de volgende grote bedreiging zijn
- Welke moleculen kunnen zonder hulp door het plasmamembraan gaan?
- Wat is het belangrijkste van diffusie in transport opgeloste cel?
- Wat was de oorspronkelijke generatie voor erwtenplanten in experiment geroepen?
- Eerste melding van wondbehandeling door een wild dier met een pijnstillende plant
- Wat bepaalt de primaire functie van een eiwit?
- Wat zouden alle delen van een cel worden vergeleken in de bibliotheek?
- Waar wordt SAP gedragen door welk plantensysteem?
- De cruciale rol van functionele motieven—microstructurele eenheden die materiële functies bepalen—in materiaalonderzoek
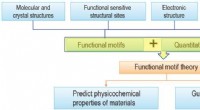
- Nieuwe fotokatalysator verhoogt de efficiëntie van watersplitsing voor schone waterstofproductie
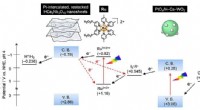
- Nieuwe aanpak suggereert pad naar emissievrij cement

- Moleculen uit moedermelk en zeewier suggereren strategieën voor het beheersen van norovirus
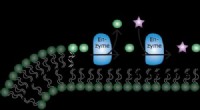
- Archaea-enzym dat membraanlipiden produceert, is spectaculair promiscue
 Webb onderzoekt een extreem sterrenstelsel
Webb onderzoekt een extreem sterrenstelsel  Stap-voor-stap wetenschapsproject waarbij Juice Pennies the Clean
Stap-voor-stap wetenschapsproject waarbij Juice Pennies the Clean Welke is stabieler van 6 en SF6?
Welke is stabieler van 6 en SF6?  Kan vervuiling het gedrag van dieren in het wild veranderen?
Kan vervuiling het gedrag van dieren in het wild veranderen? E-nose kan verschillende muntgeuren onderscheiden
E-nose kan verschillende muntgeuren onderscheiden Wetenschappers brengen de fusie-energie die de zon en de sterren verlicht, dichter bij de realiteit op aarde
Wetenschappers brengen de fusie-energie die de zon en de sterren verlicht, dichter bij de realiteit op aarde Rus naar VS gestuurd op beschuldiging dat hij Dropbox had gehackt, anderen
Rus naar VS gestuurd op beschuldiging dat hij Dropbox had gehackt, anderen Door biologische moleculen te modelleren over langere tijdschalen, een nieuw algoritme kan helpen om ziekten beter te begrijpen
Door biologische moleculen te modelleren over langere tijdschalen, een nieuw algoritme kan helpen om ziekten beter te begrijpen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

