
Wetenschap
Waarom breidt water uit naarmate het bevriest in tegenstelling tot de meeste stoffen, zodat ijs minder dicht is dan water?
1. Waterstofbinding:
* Watermoleculen zijn polair, wat betekent dat ze een enigszins positief uiteinde hebben (waterstof) en een enigszins negatief uiteinde (zuurstof).
* Deze tegengestelde ladingen trekken aan en vormen sterke waterstofbruggen tussen watermoleculen.
2. Vloeibare toestand:
* In vloeibaar water breken en hervormen de waterstofbindingen voortdurend, waardoor de moleculen vrij kunnen bewegen.
* Hierdoor kunnen watermoleculen nauw samenpakken, wat resulteert in een relatief hoge dichtheid.
3. Procesproces:
* Terwijl water afkoelt, vertragen de moleculen.
* Hierdoor kunnen de waterstofbindingen stabieler en georganiseerd worden.
* Watermoleculen rangschikken zichzelf in een kristallijne structuur en vormen een zeshoekig rooster.
4. Zeshoekig rooster:
* De zeshoekige roosterstructuur van ijs creëert veel lege ruimte tussen de watermoleculen.
* Deze open structuur is minder dicht dan de nauwere verpakking van vloeibare watermoleculen.
Het resultaat:
* De afname van de dichtheid zorgt ervoor dat ijs drijft. Dit is cruciaal voor het waterleven, omdat het voorkomt dat meren en oceanen van de bodem vast zijn, waardoor waterorganismen de winter kunnen overleven.
In tegenstelling tot de meeste stoffen:
* De meeste stoffen worden dichter naarmate ze bevriezen omdat de moleculen dichter bij elkaar inpakken in een vaste toestand.
* Water is een uitzondering vanwege de unieke waterstofbinding en de open structuur van zijn kristallijne vorm.
 Onderzoekers verminderen de tijd die nodig is voor 3D-printen van glas en keramiek sterk
Onderzoekers verminderen de tijd die nodig is voor 3D-printen van glas en keramiek sterk Is kokend water voor thee een chemische of fysieke verandering?
Is kokend water voor thee een chemische of fysieke verandering?  Waarom bevriezen het zoutwater maar deed het?
Waarom bevriezen het zoutwater maar deed het?  Makerspaces kunnen een brede acceptatie van microfluïdica mogelijk maken
Makerspaces kunnen een brede acceptatie van microfluïdica mogelijk maken Welke stof staat bekend als het universele oplosmiddel?
Welke stof staat bekend als het universele oplosmiddel?
 Vredesakkoord in Colombia heeft ontbossing van biologisch divers regenwoud doen toenemen
Vredesakkoord in Colombia heeft ontbossing van biologisch divers regenwoud doen toenemen Zure oceanen zullen koraalrifzanden binnen enkele decennia oplossen
Zure oceanen zullen koraalrifzanden binnen enkele decennia oplossen Geen tijd te verliezen:Moskou drong aan op recyclen, niet branden
Geen tijd te verliezen:Moskou drong aan op recyclen, niet branden Klimaatrapport moet doodsklok zijn voor fossiele brandstoffen:VN-chef
Klimaatrapport moet doodsklok zijn voor fossiele brandstoffen:VN-chef Hoe hebben energiedranken invloed op planten?
Hoe hebben energiedranken invloed op planten?
Hoofdlijnen
- Zo'n 230 walvissen gestrand in Tasmanië; reddingspogingen aan de gang
- Wat zijn drie banen die betrekking hebben op de wetenschap?
- Waarom bevatten de testen veel glad ER?
- De media is de boodschap:hoe stamcellen groeien hangt af van waar ze in voorkomen
- Structurele inzichten in processen op DNA-schadeplekken
- Waarom zijn mannelijke muizen bang voor bananen?
- Waarom wordt het keelholte als onderdeel van het spijsverteringssysteem beschouwd, hoewel het voedsel niet verteert of absorbeert?
- Onderzoekers onderzoeken de oorsprong van circatidale ritmes bij zoetwaterslakken
- Hoe adaptieve veranderingen in cellulaire vloeistoffen het leven in zee in staat stellen om te gaan met abiotische stressoren
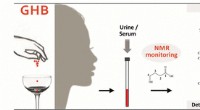
- De detectie van een date rape drug verbeteren
- Nieuw proces stimuleert lignine bio-olie als brandstof van de volgende generatie

- Implantaatinfecties kunnen worden uitgebannen dankzij doorbraak in steigers
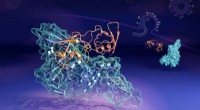
- Neutronen vangen vormveranderend coronavirus-eiwitcomplex op heterdaad
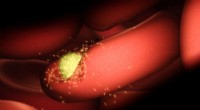
- Eerste contact tussen malaria en mens in kaart gebracht met Nobelprijswinnende technologie
 Welke supercomputer is ontwikkeld door de Indiase wetenschappers?
Welke supercomputer is ontwikkeld door de Indiase wetenschappers?  Hoe worden fossielen gevormd in boomsap?
Hoe worden fossielen gevormd in boomsap?  Kun je in de eerste 90 elementen gevallen vinden waarin opeenvolgende elementen geen toenemende atoomgewichten hebben?
Kun je in de eerste 90 elementen gevallen vinden waarin opeenvolgende elementen geen toenemende atoomgewichten hebben?  Lucht- en ruimtevaartingenieur van UTA die mogelijkheid van hypersonische passagier onderzoekt, vrachtvliegtuigen
Lucht- en ruimtevaartingenieur van UTA die mogelijkheid van hypersonische passagier onderzoekt, vrachtvliegtuigen Verdachten bekennen misdaden die ze niet hebben begaan - hier is waarom
Verdachten bekennen misdaden die ze niet hebben begaan - hier is waarom Waar kun je naartoe gaan om fossielen te vinden in Zuid -Californië?
Waar kun je naartoe gaan om fossielen te vinden in Zuid -Californië?  Wat gebeurt er in de ionosfeer?
Wat gebeurt er in de ionosfeer?  Waarom bosbranden zich anders gedragen in boreale bossen
Waarom bosbranden zich anders gedragen in boreale bossen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

