
Wetenschap
Wat zijn factoren die van invloed zijn op het chemische evenwicht?
Factoren die chemisch evenwicht beïnvloeden:
Chemisch evenwicht is een dynamische toestand waar de snelheden van voorwaartse en omgekeerde reacties gelijk zijn, wat resulteert in geen netto verandering in concentraties van reactanten en producten. Verschillende factoren kunnen dit evenwicht beïnvloeden:
1. Concentratie:
* Verhogende reactantconcentratie: Verschuift het evenwicht naar rechts en geeft de voorkeur aan productvorming.
* Verhogende productconcentratie: Verschuift het evenwicht naar links, wat de voorkeur geeft aan de vorming van de reactant.
2. Temperatuur:
* exotherme reacties: Verhogende temperatuur verschuift het evenwicht naar links, waardoor reactanten de voorkeur geven.
* Endotherme reacties: Het verhogen van de temperatuur verschuift het evenwicht naar rechts, en bevordert producten.
3. Druk:
* Gaseuze reacties: Toenemende druk is de voorkeur aan de zijkant van de reactie met minder gasmoleculen.
* vloeibare/vaste reacties: Druk heeft een verwaarloosbaar effect.
4. Toevoeging van katalysator:
* katalysatoren: Versnelling van zowel de voorwaartse als de omgekeerde reacties gelijk, wat leidt tot sneller bereiken van evenwicht, maar het niet verschuiven van zijn positie.
5. Inert gas toevoeging:
* constant volume: Toevoeging van een inert gas bij constant volume heeft geen effect op evenwicht.
* constante druk: Toevoeging van een inert gas bij constante druk verschuift het evenwicht naar de zijkant met meer gasmoleculen.
6. Le Chatelier's principe:
Een algemeen principe dat verklaart dat als een wijziging van de omstandigheden wordt toegepast op een systeem in evenwicht, het systeem zal verschuiven in een richting die de stress verlicht. Dit geldt voor alle bovenstaande factoren.
Voorbeelden:
* Haber -proces voor ammoniaksynthese:
* Verhogende stikstof- of waterstofdruk verschuift het evenwicht naar rechts, wat de voorkeur geeft aan de vorming van de ammoniak.
* Verhogende temperatuur verschuift het evenwicht naar links, waardoor reactanten de voorkeur geven.
* Oplost van calciumcarbonaat in water:
* Het toevoegen van zuur (H+) verschuift het evenwicht naar rechts, wat de voorkeur geeft aan calcium- en bicarbonaatvorming.
* Verhogende kooldioxidedruk verschuift het evenwicht naar links, wat de vorming van calciumcarbonaat bevordert.
Inzicht in de factoren die het chemische evenwicht beïnvloeden is cruciaal voor het voorspellen en beheersen van chemische reacties in verschillende industriële processen en biologische systemen.
 Nieuw inzicht in de mechanica van het rotavirus kan leiden tot verbeterde behandelingen
Nieuw inzicht in de mechanica van het rotavirus kan leiden tot verbeterde behandelingen Wat zijn de voorbeelden van intrinsief?
Wat zijn de voorbeelden van intrinsief?  Wat is het belangrijkste verschil tussen ionische en covalente bindingen?
Wat is het belangrijkste verschil tussen ionische en covalente bindingen?  Wat is de studie van perslucht?
Wat is de studie van perslucht?  Nieuwe aanpak maakt spectroscopie op individuele moleculen mogelijk
Nieuwe aanpak maakt spectroscopie op individuele moleculen mogelijk
 Luchtvervuilers situeren zich eerder in de buurt van de landsgrenzen met de wind mee
Luchtvervuilers situeren zich eerder in de buurt van de landsgrenzen met de wind mee Studie verduidelijkt het gebruik van hulpbronnen in de VS en de uitstoot van broeikasgassen
Studie verduidelijkt het gebruik van hulpbronnen in de VS en de uitstoot van broeikasgassen Slowaakse Wastebusters op kruistocht tegen zwerfvuil
Slowaakse Wastebusters op kruistocht tegen zwerfvuil Wat elk land wel en niet kan doen op Antarctica, de naam van wetenschap
Wat elk land wel en niet kan doen op Antarctica, de naam van wetenschap  Wat is de wetenschappelijke naam van guaveblad?
Wat is de wetenschappelijke naam van guaveblad?
Hoofdlijnen
- Waarom endonuclease -enzym dNA tussen 5 en 3 snijden?
- Wat zijn symbiotische relaties?
- Het raadsel van de instandhouding:hoe kies je welke soort je wilt beschermen?
- Morfologie is de studie van de?
- Wetenschappers brengen bodem-RNA in kaart met schimmelgenomen om bosecosystemen te begrijpen
- Bestudeer eerst om onkruidverdelger Roundup te koppelen aan stuiptrekkingen bij dieren
- Waar worden de chromosomen voor het eerst?
- Welke vier dingen maken ribosomen anders dan organellen?
- Onderzoekers identificeren fundamentele eigenschappen van cellen die van invloed zijn op de vorming van weefselstructuren
- CO2-neutrale waterstof uit biomassa

- Spinchemicaliën voor snellere reacties

- Kopercoating op 3D-geprinte plastic filters voorgesteld als een pandemische strijder

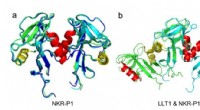
- Van atoom tot natural killer cel:het verhaal van een onverwachte eiwitstructuur
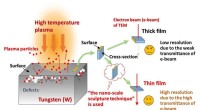
- Fusion-wetenschappers hebben een sculptuurtechniek op nanoschaal ontwikkeld
 Dankzij de gelaagdheidstechniek kunnen grafeenvezels worden gemaakt die geleidend en sterk blijven
Dankzij de gelaagdheidstechniek kunnen grafeenvezels worden gemaakt die geleidend en sterk blijven Hoe een moleculaire file de celdeling beïnvloedt
Hoe een moleculaire file de celdeling beïnvloedt  Wetenschappers nemen de temperatuur van knokkelkoorts risico
Wetenschappers nemen de temperatuur van knokkelkoorts risico En de berg bewoog:wetenschappers bestuderen hoe Heart Mountain verschoof
En de berg bewoog:wetenschappers bestuderen hoe Heart Mountain verschoof  Als je een ventilator aanzet, is de maan de windstroom?
Als je een ventilator aanzet, is de maan de windstroom?  Hoe loodrechte helling te vinden
Hoe loodrechte helling te vinden  Kap van CHEOPS ruimtetelescoop open
Kap van CHEOPS ruimtetelescoop open De spintronica-technologierevolutie kan slechts een sprong verwijderd zijn
De spintronica-technologierevolutie kan slechts een sprong verwijderd zijn
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

