
Wetenschap
Wat gebeurt er met het reactiemengsel bij equilibruim als het volume van de container wordt verhoogd?
het principe van Le Chatelier
Het principe van Le Chatelier stelt dat als een wijziging van de conditie wordt toegepast op een systeem in evenwicht, het systeem zal verschuiven in een richting die de stress verlicht.
Effect van volumeverhoging
* Stress: Het verhogen van het volume van de container vermindert de druk van het systeem.
* het verlichten van de stress: Het systeem zal verschuiven naar de voorkeur van de kant van de reactie die meer mol gas produceert.
Hoe het van toepassing is op verschillende reacties
* reacties met meer gasmolken aan de productzijde: Het evenwicht zal verschuiven naar het rechts (richting de producten) om meer gasmoleculen te produceren en de druk te verhogen.
* reacties met meer gasmolken aan de reactantzijde: Het evenwicht zal verschuiven naar de links (richting de reactanten) om gasmoleculen te consumeren en de druk te verlagen.
* reacties met gelijke gasmolken aan beide zijden: Er zal geen verschuiving zijn in evenwicht.
Voorbeeld:
Overweeg de reactie:
N 2 (g) + 3H 2 (g) ⇌ 2NH 3 (G)
* reactanten: 4 mol gas (1 mol N 2 + 3 mol h 2 ))
* Producten: 2 mol gas
Als het volume wordt verhoogd, verschuift het evenwicht naar de links (richting de reactanten) om meer gasmoleculen te produceren en de drukafname gedeeltelijk te verlichten.
belangrijke opmerkingen:
* concentratie verandert: Hoewel volumeveranderingen de druk beïnvloeden, beïnvloeden ze ook indirect de concentraties van reactanten en producten.
* Temperatuurveranderingen: Het veranderen van de temperatuur kan ook de evenwichtspositie beïnvloeden, vaak op een andere manier dan het veranderen van het volume.
Laat het me weten als je nog andere vragen hebt over chemisch evenwicht!
 Zoekmachine voor slim hout
Zoekmachine voor slim hout Voor ernstig zieke patiënten op life support, scheikunde kan hen helpen overleven
Voor ernstig zieke patiënten op life support, scheikunde kan hen helpen overleven Moleculaire oriëntatie is de sleutel:nieuw licht werpen op elektronengedrag met behulp van 2-foton foto-emissiespectroscopie
Moleculaire oriëntatie is de sleutel:nieuw licht werpen op elektronengedrag met behulp van 2-foton foto-emissiespectroscopie  Hoe lees je een chemische reactie?
Hoe lees je een chemische reactie?  Hoe meet je de pH zonder een meter?
Hoe meet je de pH zonder een meter?
 Aanpak van het stedelijke hitte-effect in nieuw onderzoeksrapport over het koelen van gemeenschappelijke ruimtes
Aanpak van het stedelijke hitte-effect in nieuw onderzoeksrapport over het koelen van gemeenschappelijke ruimtes Wat is aardevriendelijke landbouw?
Wat is aardevriendelijke landbouw?  1e grote bosbrand in Zuid-Californië van 2020 blijft woeden
1e grote bosbrand in Zuid-Californië van 2020 blijft woeden Zou u behalve om een grotere biodiversiteit te vinden in het natuurlijke ecosysteem of door de mens gemaakte, zoals boerder, een tuin, uw antwoord uitleggen?
Zou u behalve om een grotere biodiversiteit te vinden in het natuurlijke ecosysteem of door de mens gemaakte, zoals boerder, een tuin, uw antwoord uitleggen?  Hoe kan de rest van het land zich voorbereiden op bosbranden zoals die in Californië?
Hoe kan de rest van het land zich voorbereiden op bosbranden zoals die in Californië?
Hoofdlijnen
- Wat zijn manieren waarop eencellige organismen verschillen van elkaar?
- Bacteriecellen zijn meestal veel groter dan eukaryotische cellen?
- Wat zijn de verschillen tussen de evolutietheorie en tegenstrijdige theorieën?
- Hoe ‘slapende’ micro-organismen het lot van een populatie kunnen bepalen
- Eiwitfamilie laat zien hoe het leven zich aanpaste aan zuurstof
- Welke sequentie heeft een DNA-streng met de basensequentie tgacgca die codeert voor a of mrna?
- Wanneer gebruiken mensen fermentatie?
- Heb je de bacteriële celwand of cytoplasma gekleurd?
- Hoe zijn hypothese en conculsie gerelateerd?
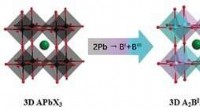
- Onderzoekers ontwikkelen halide dubbele perovskiet ferro-elektriciteit
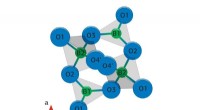
- Chemici ontdekken het mechanisme van stralingsinstabiliteit van lithiumtetraboraat
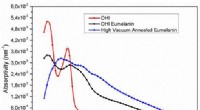
- Zullen cyborgs gemaakt worden van melanine? Pigmentdoorbraak maakt biocompatibele elektronica mogelijk
- Sensor voor vroegtijdige waarschuwing snuffelt schadelijk gas uit steden

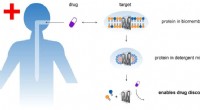
- Nieuwe wasmiddelen voor geneesmiddelenonderzoek
 Driedimensionale weergave van katalysatoren in actie
Driedimensionale weergave van katalysatoren in actie Nieuw onderzoek onthult wat er op het menu stond voor middeleeuwse boeren
Nieuw onderzoek onthult wat er op het menu stond voor middeleeuwse boeren  Welk percentage water zijn menselijke lichaamscellen?
Welk percentage water zijn menselijke lichaamscellen?  Wat is er allemaal zo moeilijk aan 5G?
Wat is er allemaal zo moeilijk aan 5G? Hoe toongenerators werken
Hoe toongenerators werken  Metallurgie:de studie van metalen en hun eigenschappen
Metallurgie:de studie van metalen en hun eigenschappen  Urbach Tower biedt uitzicht op zelfvormende architectuur
Urbach Tower biedt uitzicht op zelfvormende architectuur Nieuwe studie verdrievoudigt schatting van red snapper in Golf van Mexico
Nieuwe studie verdrievoudigt schatting van red snapper in Golf van Mexico
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

