
Wetenschap
Wat is het belangrijkste verschil tussen ionische en covalente bindingen?
Ionische obligaties:
Bij ionische bindingen wordt het elektronenpaar volledig overgedragen van het ene atoom naar het andere, wat resulteert in de vorming van positief geladen ionen (kationen) en negatief geladen ionen (anionen). De elektrostatische aantrekkingskracht tussen deze tegengesteld geladen ionen houdt de ionische verbinding bij elkaar.
Kenmerken van ionische obligaties:
- Betrek een volledige overdracht van elektronen.
- Resultaat in de vorming van ionen.
- Sterke elektrostatische aantrekkingskracht tussen ionen.
- Meestal gevormd tussen een metaal en een niet-metaal.
- Verbindingen zijn kristallijne vaste stoffen bij kamertemperatuur.
- Over het algemeen oplosbaar in polaire oplosmiddelen zoals water.
Covalente obligaties:
Bij covalente bindingen worden elektronen gedeeld tussen atomen zonder volledige overdracht. Het gedeelde elektronenpaar vormt een gebied met een hoge elektronendichtheid tussen de gebonden atomen, waardoor een stabiele moleculaire structuur ontstaat.
Kenmerken van covalente obligaties:
- Betreft het delen van elektronenparen.
- Veroorzaakt geen vorming van ionen.
- Sterkte hangt af van het aantal gedeelde elektronenparen.
- Typisch gevormd tussen niet-metalen.
- Kan polair of niet-polair zijn, afhankelijk van de verschillen in elektronegativiteit.
- Verbindingen kunnen bij kamertemperatuur voorkomen als gassen, vloeistoffen of vaste stoffen.
- Over het algemeen onoplosbaar in polaire oplosmiddelen, maar oplosbaar in niet-polaire oplosmiddelen.
 Ontwikkeling van een nieuwe magneet die het gebruik van zeldzame aardmetalen met 30% vermindert
Ontwikkeling van een nieuwe magneet die het gebruik van zeldzame aardmetalen met 30% vermindert Geavanceerde hyperspectrale teledetectie per uur-hectometer voor fijnschalige atmosferische emissies
Geavanceerde hyperspectrale teledetectie per uur-hectometer voor fijnschalige atmosferische emissies  Wat is de chemische vergelijking voor ferrosulfaat met koperdraad?
Wat is de chemische vergelijking voor ferrosulfaat met koperdraad?  Naar een milieuvriendelijke productie van actieve farmaceutische ingrediënten met een flowreactor
Naar een milieuvriendelijke productie van actieve farmaceutische ingrediënten met een flowreactor Universiteit van Minnesota meldt doorbraak in 3D-printen voor herstel van het ruggenmerg
Universiteit van Minnesota meldt doorbraak in 3D-printen voor herstel van het ruggenmerg
 Nieuw-Zeelandse aardbevingswetenschappers ontdekken verrassing:heet water
Nieuw-Zeelandse aardbevingswetenschappers ontdekken verrassing:heet water Fouten in grootschalige, convectieve tropische neerslagsimulaties hebben invloed op klimaatfeedback
Fouten in grootschalige, convectieve tropische neerslagsimulaties hebben invloed op klimaatfeedback Als een mot op een vlam
Als een mot op een vlam Zelfs in een waterrijk land als Nieuw-Zeeland, sommige steden kunnen deze zomer te maken krijgen met watertekorten
Zelfs in een waterrijk land als Nieuw-Zeeland, sommige steden kunnen deze zomer te maken krijgen met watertekorten De levenscyclus van de tomaat Hornworm
De levenscyclus van de tomaat Hornworm
Hoofdlijnen
- Ontdekking van aminozuur onthult hoe licht huidmondjes in planten open maakt
- Hoe wild is het Bengaalse kattengenoom?
- Wetenschappers ontdekken hoe een motoreiwit cellen helpt bewegen
- Hoe de mitochondriën van een cel hun eigen eiwitfabrieken maken
- Ultraconserverde elementen in het genoom:zijn ze onmisbaar?
- Gedeeld overlevingsmechanisme verklaart waarom 'goede' zenuwcellen blijven bestaan en 'slechte' kanker floreert
- Prokaryotische celstructuur
- Hoe het genoom zijn functionele microarchitectuur bepaalt
- Hoe hersendood werkt
- Een nieuwe manier om medicijnen af te leveren in MOF's

- Een biosensor detecteert binnen een uur vervalsing van paard in rundvlees

- MiNT-eiwit een nieuw doelwit om ziekte aan te vallen
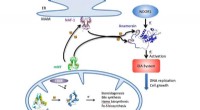
- Een stabiele koperkatalysator voor de omzetting van kooldioxide

- Mechanisme achter de elektrische ladingen gegenereerd door fotosynthese
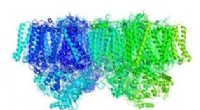
 Het klimaat verandert zo snel dat we niet hebben gezien hoe slecht extreem weer kan zijn
Het klimaat verandert zo snel dat we niet hebben gezien hoe slecht extreem weer kan zijn  Hoe ruimtetijd wordt opgebouwd door kwantumverstrengeling
Hoe ruimtetijd wordt opgebouwd door kwantumverstrengeling  NASA vangt aanlanding tropische cycloon Gajas
NASA vangt aanlanding tropische cycloon Gajas Aardgaspijpen lassen
Aardgaspijpen lassen  Proces in rechtszaak over politietoezicht op demonstranten eindigt
Proces in rechtszaak over politietoezicht op demonstranten eindigt Hoe vloeistofviscositeit de intensiteit van aardbevingen beïnvloedt
Hoe vloeistofviscositeit de intensiteit van aardbevingen beïnvloedt Onderzoekers werpen licht op hoe één dodelijke ziekteverwekker zijn chemicaliën maakt
Onderzoekers werpen licht op hoe één dodelijke ziekteverwekker zijn chemicaliën maakt  Evolueert de mens sneller? Uit onderzoek blijkt dat we steeds meer verschillend worden, en niet meer hetzelfde
Evolueert de mens sneller? Uit onderzoek blijkt dat we steeds meer verschillend worden, en niet meer hetzelfde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

