
Wetenschap
Kan waterstof binding maken met alkali -metalen?
* elektropositiviteit: Alkali -metalen zijn zeer elektropositief, wat betekent dat ze hun enkele valentie -elektron gemakkelijk verliezen om positief geladen ionen (kationen) te worden.
* elektronegativiteit: Waterstof is relatief elektronegatief, wat betekent dat het de neiging heeft om een elektron te krijgen om een negatief geladen ion (anion) te worden of elektronen te delen om covalente bindingen te vormen.
Het verschil in elektronegativiteit is te groot voor een typische ionische of covalente binding om te vormen.
Er zijn echter enkele uitzonderingen:
* Interstitiële hydrides: Sommige alkali -metalen kunnen interstitiële hydrides vormen , waar waterstofatomen de ruimtes tussen de metaalatomen in het kristalrooster bezetten. Dit is meer een fysieke interactie dan een echte chemische binding.
* Onder extreme omstandigheden: Onder extreem hoge drukken is waargenomen dat sommige alkali -metalen reageren met waterstof om *ionische hydriden te vormen *. Dit komt door de extreme druk die de waterstofatomen dwingt zich meer als anionen te gedragen.
Samenvattend: Hoewel waterstof- en alkali -metalen meestal niet in normale omstandigheden aan elkaar worden gevonden, zijn er enkele uitzonderingen onder extreme omstandigheden of in specifieke vormen zoals interstitiële hydriden.
 Reageert ijzer met geconcentreerd salpeterzuur?
Reageert ijzer met geconcentreerd salpeterzuur?  Nieuwe tool haalt ongrijpbare COVID-19-marker uit menselijk bloed
Nieuwe tool haalt ongrijpbare COVID-19-marker uit menselijk bloed Het overwinnen van de uitdagingen bij gecontroleerde thermische depositie van organische diradicalen
Het overwinnen van de uitdagingen bij gecontroleerde thermische depositie van organische diradicalen Optimalisatie van de elektrolyten van lithium-zwavelbatterijen voor een lange levensduur
Optimalisatie van de elektrolyten van lithium-zwavelbatterijen voor een lange levensduur Onderzoekers ontdekken zeer actieve organische fotokatalysator
Onderzoekers ontdekken zeer actieve organische fotokatalysator
 Lijst met dingen die kikkervisjes eten
Lijst met dingen die kikkervisjes eten  Wetlands spelen een cruciale rol bij koolstofopslag, studie vondsten
Wetlands spelen een cruciale rol bij koolstofopslag, studie vondsten De temperatuur in Delhi bereikt de hoogste temperatuur ooit in India:weerbureau
De temperatuur in Delhi bereikt de hoogste temperatuur ooit in India:weerbureau  EPA-chef belooft het opruimen van vervuiling door Superfund te stroomlijnen
EPA-chef belooft het opruimen van vervuiling door Superfund te stroomlijnen Experts verklaren het effect van klimaatverandering op infrastructuur
Experts verklaren het effect van klimaatverandering op infrastructuur
Hoofdlijnen
- Wat maakt een zoogdier tot zoogdier? Onze ruggengraat, zeggen wetenschappers
- Evolutionair celbiologisch onderzoek laat zien hoe de energieproductie kan worden geoptimaliseerd om snelle groei zonder ademhaling te garanderen
- Genoomanalyse van vroege plantenafstamming werpt licht op hoe planten leerden te gedijen op het land
- Leren wat de kern doet tikken
- Wat zijn de celorganellen gevuld met enzymen die nodig zijn om bepaalde materialen in cel af te breken?
- Fruitvliegonderzoek kan onthullen wat er in de hersenen van vrouwen gebeurt tijdens verkering en paring
- UW-wetenschappers ontrafelen het mysterie van hoe griepvirussen zich vermenigvuldigen
- Met software kunnen onderzoekers kleine ronde voorwerpen uit DNA maken. Dit is waarom dat cool is
- Wetenschappers brengen nieuwe inzichten in de erfelijkheid van de ernst van de hiv-infectie
- Video:Rijdt uw brandstofcelauto... op benzine?

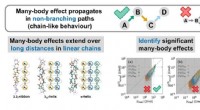
- Wanneer zijn veellichaamseffecten significant?
- Winnaars van een wedstrijd van $ 20 miljoen maken beton om koolstofdioxide op te vangen

- Zo mooi als een pauw:de edelsteen voor de volgende generatie slimme sensoren

- Röntgenfoto's onthullen lay-out van geladen drugstransporter
 Hoeveel inches zijn er in 1,4 meter?
Hoeveel inches zijn er in 1,4 meter?  Waar worden organellen van een diercellen gevonden?
Waar worden organellen van een diercellen gevonden?  In het verschroeide VK droogt de bron van de rivier de Theems op
In het verschroeide VK droogt de bron van de rivier de Theems op Crematie hoe werkt
Crematie hoe werkt  Flipped classroom verbetert de leerresultaten in het onderwijs met medische certificaten
Flipped classroom verbetert de leerresultaten in het onderwijs met medische certificaten Welke van de volgende elementen uit Groep 18 vormt het meest waarschijnlijk een verbinding met fluor?
Welke van de volgende elementen uit Groep 18 vormt het meest waarschijnlijk een verbinding met fluor?  Archeologen vinden overblijfselen van tempel uit het Romeinse tijdperk in Egypte
Archeologen vinden overblijfselen van tempel uit het Romeinse tijdperk in Egypte Hoe olieboringen werken
Hoe olieboringen werken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

