
Wetenschap
3D-structuur van enzym opent pad naar nieuw medicijnontwerp bij hersenziekte
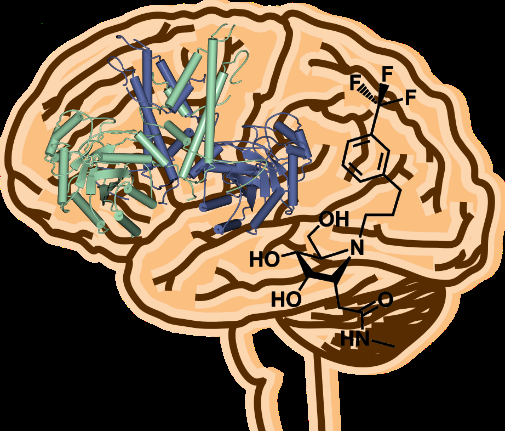
Geneesmiddelen kunnen worden ontworpen op basis van de 3D-structuur van dit menselijke enzym. Krediet:Universiteit van York
Onderzoekers van de Universiteit van York en Simon Fraser University, Canada, onthulde de 3D-structuur van een enzym dat een cruciale stap voorwaarts zou kunnen zijn bij de behandeling van neurodegeneratieve ziekten.
Eerder werk van deze onderzoeksteams onderzocht een klasse van ziekten die tauopathieën worden genoemd, die optreden wanneer tau-eiwitten zich spontaan in de hersenen groeperen. Het wordt vaak geassocieerd met de ziekte van Alzheimer en andere neurodegeneratieve ziekten.
Onderzoek heeft aangetoond dat het tau-eiwit kan worden gewijzigd door een suiker, natuurlijk voor het lichaam, genaamd O-GlcNAc. Deze suiker kan het eiwit stabiliseren om te voorkomen dat het samenklontert en kan daardoor ziekte voorkomen. Het menselijke enzym O-GlcNAc-hydrolase, echter, is verantwoordelijk voor de verwijdering van deze cruciale suiker uit het eiwit, waardoor het een belangrijk doelwit is bij het voorkomen van de progressie van tau-gerelateerde dementie.
Om te begrijpen hoe deze klontering van tau kan worden voorkomen of verminderd door O-GlcNAc te verhogen, wetenschappers in York onderzochten de structuur van het menselijke enzym om te onthullen hoe het is georganiseerd om op deze manier te functioneren.
Nieuwe doorbraken
Professor Gideon Davies, van de afdeling scheikunde van de universiteit, zei:"Het remmen van het O-GlcNAc-hydrolase-enzym stelt wetenschappers in staat om tau te stabiliseren. We hebben de driedimensionale structuur van het enzym opgelost om op structuur gebaseerd medicijnontwerp te ondersteunen. De ongebruikelijke en complexe organisatie zou ons moeten helpen bij het zoeken naar nieuwe medicijnen voor de behandeling van neurodegeneratieve ziekten.
"Drugs kunnen worden ontworpen op basis van de 3D-structuur van dit menselijke enzym, wat uiteindelijk de weg vrijmaakt voor nieuwe doorbraken in de behandeling van ziekten zoals de ziekte van Alzheimer."
Professor David Vocadlo, van de Simon Fraser-universiteit, zei:"Naast het dienen als blauwdruk voor de ontwikkeling van antagonisten, deze lang gezochte structuur onthult een verrassende architectuur die kan leiden tot een beter begrip van hoe dit belangrijke enzym in cellen wordt gereguleerd. Dergelijke inzichten kunnen leiden tot meer gerichte therapieën voor verschillende ziekten."
Sleutel tot een slot
Dokter Rosa Sancho, Head of Research bij Alzheimer's Research UK die dit werk medefinancierde, zei:"Het ontdekken van drugs is een beetje als het ontwerpen van een sleutel die op een slot past, echter, het is belangrijk om de vorm te kennen van het slot waarmee u werkt. Deze nieuwe studie beschrijft in detail de vorm van O-GlcNAc-hydrolase en maakt de weg vrij voor het ontwerp van medicijnen die in dit slot passen. Toekomstige studies zullen moeten onderzoeken of medicijnen die dit enzym kunnen remmen veelbelovend zijn voor de behandeling van de ziekte van Alzheimer en andere vormen van dementie. maar dit is een belangrijke stap in de goede richting.
"Met 850, 000 mensen in het VK die momenteel lijden aan dementie en geen nieuwe behandelingen hebben goedgekeurd in de afgelopen tien jaar, er is dringend behoefte aan nieuwe en innovatieve strategieën om de aandoening het hoofd te bieden."
Het onderzoek is gepubliceerd in Natuur Chemische Biologie .
 Een zeldzame prestatie:materiaal beschermt tegen zowel biologische als chemische bedreigingen
Een zeldzame prestatie:materiaal beschermt tegen zowel biologische als chemische bedreigingen Gemengde valentietoestanden in loodperovskieten
Gemengde valentietoestanden in loodperovskieten Speciale eiwitrijke planten zorgen voor eiwitten, vezels en antioxidanten in één verpakking
Speciale eiwitrijke planten zorgen voor eiwitten, vezels en antioxidanten in één verpakking Op Mars of de aarde, biohybride kan koolstofdioxide omzetten in nieuwe producten
Op Mars of de aarde, biohybride kan koolstofdioxide omzetten in nieuwe producten Met trucs voor materiaalverwerking kunnen ingenieurs nieuw lasermateriaal maken
Met trucs voor materiaalverwerking kunnen ingenieurs nieuw lasermateriaal maken
Hoofdlijnen
- Hoe werkt ATP?
- Hoe meten we pijn?
- Wetenschappers maken volgnanoagentia om zeer kleine zieke weefsels te verlichten
- Voorbeelden van diffusie in organen
- Belang van diffusie in organismen
- Fenotype: definitie, types, voorbeelden
- Kun jij een paar haren van een renpaard stelen en je eigen haren klonen?
- Hoe bacteriën worden gereproduceerd?
- Er wordt een verrassende nieuwe vlindervis beschreven uit de Filippijnse schemerzone en tentoonstelling
- Peptidepapieren wijzen op nieuwe manieren om bacteriën aan te pakken

- Weet jij de weg naar Berkelium, Californië?

- Nieuw onderzoek optimaliseert zowel elasticiteit als stijfheid in hetzelfde materiaal zonder de gebruikelijke compromissen

- Onderzoekers gebruiken AI om groene route naar nylon uit te stippelen

- Carbon black gerecycled uit autobanden

 JAXA gebruikt waterflestechnologie voor monsterretourmissies vanuit het ISS
JAXA gebruikt waterflestechnologie voor monsterretourmissies vanuit het ISS Zekerheid in complex wetenschappelijk onderzoek een onhaalbaar doel
Zekerheid in complex wetenschappelijk onderzoek een onhaalbaar doel Zeeslak gevonden in Florida Keys is de nieuwste exotische indringer van de staat
Zeeslak gevonden in Florida Keys is de nieuwste exotische indringer van de staat Betaalbare en mobiele zuivering van dialysewater
Betaalbare en mobiele zuivering van dialysewater Henri upgrade naar orkaan omdat het de Amerikaanse kust bedreigt
Henri upgrade naar orkaan omdat het de Amerikaanse kust bedreigt Slanke telescoop haalt het in de Big Apple
Slanke telescoop haalt het in de Big Apple IPCC-rapport schetst catastrofaal beeld van smeltend ijs en stijgende zeespiegel - en de realiteit kan nog erger zijn
IPCC-rapport schetst catastrofaal beeld van smeltend ijs en stijgende zeespiegel - en de realiteit kan nog erger zijn Amerikaans chipbedrijf zegt dat het sommige items legaal aan Huawei mag verkopen
Amerikaans chipbedrijf zegt dat het sommige items legaal aan Huawei mag verkopen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Norway | French | Danish |

-
Wetenschap © https://nl.scienceaq.com

