
Wetenschap
Hoe passen deeltjes opgeloste stof en oplosmiddelen in elkaar?
1. Polaire opgeloste stoffen en polaire oplosmiddelen (zoals oplost zoals)
* Voorbeeld: Suiker (opgeloste) opgelost in water (oplosmiddel)
* interactie: Polaire moleculen hebben ongelijke ladingsverdeling, waardoor positieve en negatieve uiteinden ontstaan. Water is zeer polair met een sterk dipoolmoment. Suikermoleculen hebben polaire hydroxylgroepen (-oH). Deze tegengestelde ladingen trekken zich aan en vormen waterstofbruggen tussen de opgeloste stof en oplosmiddel.
* pasvorm: De polaire opgeloste stof- en oplosmiddelmoleculen stemmen zichzelf uit, met positieve uiteinden van het ene molecuul die negatieve uiteinden van een ander aantrekken. Dit creëert een sterke aantrekkingskracht en maakt het mogelijk dat de opgeloste deeltjes gelijkmatig in het oplosmiddel worden verspreid.
2. Niet -polaire opgeloste stoffen en niet -polaire oplosmiddelen (zoals oplost zoals)
* Voorbeeld: Olie (opgeloste) opgelost in benzine (oplosmiddel)
* interactie: Niet -polaire moleculen hebben een uniforme ladingsverdeling. Ze interageren voornamelijk via zwakke Van der Waals Forces (London Dispersion Forces).
* pasvorm: De niet -polaire opgeloste stof- en oplosmiddelmoleculen kunnen gemakkelijk mengen omdat ze vergelijkbare intermoleculaire krachten delen. De moleculen vormen geen sterke bindingen, maar ze zijn in staat om te vermengen vanwege hun vergelijkbare aantrekkingskracht en afstotingskenmerken.
3. Ionische opgeloste stoffen en polaire oplosmiddelen
* Voorbeeld: Zout (NaCl) opgelost in water
* interactie: Ionische verbindingen zijn samengesteld uit geladen ionen (kationen en anionen). Polaire oplosmiddelen zoals water hebben sterke dipoolmomenten en kunnen de ionen aantrekken en omringen, ze uit elkaar trekken en ze scheiden van het kristalrooster. Dit proces wordt hydratatie genoemd.
* pasvorm: De positieve uiteinden van watermoleculen omringen de anionen en de negatieve uiteinden van watermoleculen omringen de kationen. De sterke aantrekkingskracht tussen de ionen en de polaire watermoleculen zorgt ervoor dat de ionische verbinding oplost.
4. Uitzonderingen en meer complexe gevallen
* Oplosbaarheid: De mate waarin een opgeloste oplossing in een oplosmiddel oplost, hangt af van de sterkte van de interacties tussen de opgeloste moleculen en oplosmiddel. Soms kan een kleine hoeveelheid niet -polaire opgeloste stof oplossen in een polair oplosmiddel als gevolg van zwakke interacties.
* Complexe moleculen: Grotere moleculen met meerdere functionele groepen kunnen zowel polaire als niet -polaire regio's hebben. Hun oplosbaarheid wordt bepaald door de balans van deze interacties.
Samenvattend:
De manier waarop opgeloste en oplosmiddeldeeltjes in elkaar passen, hangt af van hun polariteit en het type intermoleculaire krachten die ze vertonen. "Like Los List Like" is een algemene vuistregel:polaire opgeloste stoffen lossen goed op in polaire oplosmiddelen, en niet -polaire opgeloste stoffen lossen goed op in niet -polaire oplosmiddelen. Ionische opgeloste stoffen lossen vaak op in polaire oplosmiddelen door sterke ion-dipool interacties.
 Wat maakt een oplosmiddel polair?
Wat maakt een oplosmiddel polair?  De meeste verontreinigende stoffen in de oceaan komen vandaan?
De meeste verontreinigende stoffen in de oceaan komen vandaan?  Hoe verschilt het metaal magnesium van calcium in hun reactie met water?
Hoe verschilt het metaal magnesium van calcium in hun reactie met water?  Xylitol en cellulose nanovezels maken van papierpasta – naar een groene en duurzame samenleving
Xylitol en cellulose nanovezels maken van papierpasta – naar een groene en duurzame samenleving Moleculaire schakelaar maakt fotomechanisch springen van polymeren mogelijk
Moleculaire schakelaar maakt fotomechanisch springen van polymeren mogelijk
 Europese insecten verspreidden zich over de hele wereld. Was het omdat kolonisten planten droegen?
Europese insecten verspreidden zich over de hele wereld. Was het omdat kolonisten planten droegen?  NASA volgt tropische storm Laura in de buurt van Cuba
NASA volgt tropische storm Laura in de buurt van Cuba Euraziatische anomalieën in de atmosferische circulatie kunnen van de winter tot de volgende lente aanhouden
Euraziatische anomalieën in de atmosferische circulatie kunnen van de winter tot de volgende lente aanhouden Visserijlengte, inspanning van de visser:hoe ze zich verhouden
Visserijlengte, inspanning van de visser:hoe ze zich verhouden  In de eerste wereld, Nieuw-Zeeland verplicht banken klimaatimpact te rapporteren
In de eerste wereld, Nieuw-Zeeland verplicht banken klimaatimpact te rapporteren
Hoofdlijnen
- Wat gebeurt er als er geen zuurstof beschikbaar is aan het einde van langzame glycolyse?
- Hoe komt bacteriën van planten?
- Hoe bacteriën zo snel reageren op externe veranderingen
- Nee,
- Wat maakt mensen menselijk?
- Wat zijn de overeenkomsten en verschillen met lipiden zetmeel?
- Een beter nest ontwerpen om bedreigde schildpadden te helpen
- Wat is het voordeel van het hebben van twee hosts voor een parasiet?
- Onderzoekers ontwikkelen een genoom op bijna chromosoomniveau voor de Mojave-papaverbij
- Onderzoek effent de weg voor de volgende generatie kristallijne materiaalzeefapparatuur

- Chemici ontwikkelen een raamwerk om een efficiënte synthese van informatierijke moleculen mogelijk te maken
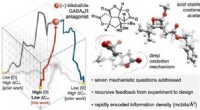
- Nieuwe aanpak maakt het gemakkelijker om nieuwe medicijnen te vinden
- Neutronentomografie:inzicht in het inwendige van tanden, wortel ballen, batterijen, en brandstofcellen

- Stikstof komt op de snelle rijstrook voor chemische synthese
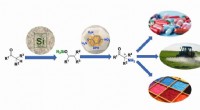
 Hoe te bewijzen dat je buitenaards leven hebt ontdekt:nieuw onderzoek biedt een gids
Hoe te bewijzen dat je buitenaards leven hebt ontdekt:nieuw onderzoek biedt een gids  Onderzoek toont aan hoe het gebruik van mentale strategieën het beloningscircuit van de hersenen kan veranderen
Onderzoek toont aan hoe het gebruik van mentale strategieën het beloningscircuit van de hersenen kan veranderen  Voorbij qubits:team zet volgende grote stap om quantum computing op te schalen
Voorbij qubits:team zet volgende grote stap om quantum computing op te schalen Populisme barst los wanneer mensen zich niet verbonden en niet gerespecteerd voelen
Populisme barst los wanneer mensen zich niet verbonden en niet gerespecteerd voelen Techbedrijf Slack maakt marktdebuut voor $26 referentieprijs
Techbedrijf Slack maakt marktdebuut voor $26 referentieprijs Watchdog:Westerse technologie gebruikt voor hacking in Turkije, Syrië
Watchdog:Westerse technologie gebruikt voor hacking in Turkije, Syrië Wat hebben alle soorten materie gemeen?
Wat hebben alle soorten materie gemeen?  Wie heeft het classifactiesysteem uitgevonden?
Wie heeft het classifactiesysteem uitgevonden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

