
Wetenschap
Waarom zijn halogenen oxiderende middelen?
Elektronegativiteit:
* Halogenen hebben een hoge elektronegativiteit, wat betekent dat ze elektronen sterk aantrekken. Dit maakt hen te popelen om een elektron te krijgen om hun octet te voltooien en een stabiele elektronische configuratie te bereiken.
Elektronenaffiniteit:
* Halogenen hebben een hoge elektronenaffiniteit, wat de hoeveelheid energie die wordt vrijgegeven wanneer een atoom een elektron verkrijgt. Dit betekent dat ze gemakkelijk elektronen accepteren en negatief geladen ionen worden (halogenide -ionen).
oxidatie:
* Oxidatie is het proces van het verliezen van elektronen. Wanneer een halogeen reageert met een ander element, krijgt het een elektron van dat element, waardoor het andere element wordt geoxideerd (verlies elektronen).
Voorbeeld:
Beschouw de reactie van chloorgas (CL2) met natriummetaal (NA):
* 2na (s) + Cl2 (g) → 2Nacl (s)
In deze reactie:
* Chloor (CL2) krijgt een elektron van natrium (NA), wordt een chloride-ion (Cl-) en wordt gereduceerd.
* Natrium (NA) verliest een elektron, wordt een natriumion (Na+) en wordt geoxideerd.
Samenvatting:
Halogenen zijn uitstekende oxidatiemiddelen omdat ze zeer elektronegatief zijn, een hoge elektronenaffiniteit hebben en elektronen van andere elementen gemakkelijk accepteren, waardoor deze elementen worden geoxideerd. Daarom worden ze in veel chemische reacties gebruikt om oxidatie te introduceren.
 Boombedekking is niet genoeg voor duurzame ontwikkeling, een globale kaart van de natuurlijkheid van bossen is ook vereist
Boombedekking is niet genoeg voor duurzame ontwikkeling, een globale kaart van de natuurlijkheid van bossen is ook vereist Hagedissen die in Tennessee leven
Hagedissen die in Tennessee leven  Oceaanstromingen dreigen de Antarctische ijsplaten te laten instorten, zo blijkt uit onderzoek
Oceaanstromingen dreigen de Antarctische ijsplaten te laten instorten, zo blijkt uit onderzoek  Mangroven in Zuid-Florida zijn op dodenmars, markeert een nieuw tijdperk voor de aarde
Mangroven in Zuid-Florida zijn op dodenmars, markeert een nieuw tijdperk voor de aarde Fast fashion-leugens:zullen ze echt hun leven veranderen in een klimaatcrisis?
Fast fashion-leugens:zullen ze echt hun leven veranderen in een klimaatcrisis?
Hoofdlijnen
- Wat zijn levende wezens die hun voedsel moeten innemen of absorberen?
- Openbare bronnen stimuleren de ontdekking van medicijnen en bieden inzicht in de eiwitfunctie
- Waar codeert een groep van drie nucleotiden voor?
- Wat vormt het darmmicrobioom van bruine beren in Alaska? Locatie, locatie, locatie
- Stelt de celtheorie dat alle cellen voortkomen uit andere cellen?
- Wat heeft wetenschapper Robert Whittaker Develope?
- Wat zou het aminozuur zijn als er een mutatie was en UAG veranderde in UCG?
- Wat maakt een agressieve hond en hoe herken je er een?
- Cilia in 3D:miniatuur treinstation ontdekt
- Synthetische organellen laten zien hoe kleine plas-organen in onze cellen werken
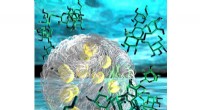
- Beeldvorming van mRNA precies daar waar het is gemaakt - op de plaats van vertaling
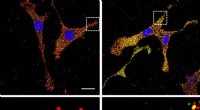
- nieuwe efficiënte, lage-temperatuurkatalysator voor waterstofproductie

- Draait op leeg:nieuwe betaalbare katalysator is afhankelijk van stikstoftekorten om ammoniak te produceren

- Pijnloze huidpleister verzamelt vloeistof voor diagnostische tests

 Monty Pythons domme wandeling:een loopanalyse en een wake-up call om inefficiënties door vakgenoten te beoordelen
Monty Pythons domme wandeling:een loopanalyse en een wake-up call om inefficiënties door vakgenoten te beoordelen Wat is de chemische naam voor lijm?
Wat is de chemische naam voor lijm?  Hoe krijgen we onze energie als meer dan één manier?
Hoe krijgen we onze energie als meer dan één manier?  Wat zijn de eigenschappen en kenmerken van statische elektriciteit?
Wat zijn de eigenschappen en kenmerken van statische elektriciteit?  Nee, we zullen de bedrijfswereld niet veranderen met desinvesteringen en boycots
Nee, we zullen de bedrijfswereld niet veranderen met desinvesteringen en boycots Waarom de revolutie in elektrische voertuigen zijn eigen problemen met zich mee zal brengen
Waarom de revolutie in elektrische voertuigen zijn eigen problemen met zich mee zal brengen  Hoeveel oz suiker is gelijk aan 110 gram?
Hoeveel oz suiker is gelijk aan 110 gram?  Tijdomkeringsmethoden kunnen stroomtransformatoren betrouwbaarder maken
Tijdomkeringsmethoden kunnen stroomtransformatoren betrouwbaarder maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

