
Wetenschap
Wat gebeurt er wanneer NAC1 wordt toegevoegd aan water?
ontbinding:
1. ionisatie: De sterke ionische bindingen die het natrium (Na+) en chloride (Cl-) ionen in het NaCl-kristalrooster vasthouden, worden verstoord door de polaire watermoleculen.
2. Hydratatie: Het positieve uiteinde van het watermolecuul (waterstof) wordt aangetrokken door de negatief geladen chloride-ionen (Cl-), terwijl het negatieve uiteinde van het watermolecuul (zuurstof) wordt aangetrokken door de positief geladen natriumionen (Na+). Deze aantrekkingskracht vormt hydratatieschalen rond de ionen en trekt ze effectief uit het kristalrooster.
3. Dissociatie: Naarmate het hydratatieproces voortduurt, worden de Na+ en clies volledig omgeven door watermoleculen, waardoor ze van elkaar worden gescheiden en ze vrij kunnen bewegen in de oplossing. Dit proces wordt dissociatie genoemd.
Resultaat:
* De NaCl lost op in water en vormt een homogene oplossing.
* De oplossing leidt elektriciteit vanwege de aanwezigheid van vrije ionen (Na+ en Cl-).
* Het water wordt enigszins zout.
Belangrijke opmerking:
* Het oplossend proces is een endotherme reactie, wat betekent dat het warmte van de omgeving absorbeert. Dit is de reden waarom het toevoegen van zout aan water het vriespunt kan verlagen en het kookpunt kan verhogen.
* Niet alle zouten lossen in water in dezelfde mate op. De oplosbaarheid van een zout hangt af van factoren zoals temperatuur, de sterkte van de ionische bindingen en de polariteit van het oplosmiddel.
 Nieuwe kooldioxide-adsorberende kristallen voor biomedische materialen die afhankelijk zijn van vormgeheugeneffect
Nieuwe kooldioxide-adsorberende kristallen voor biomedische materialen die afhankelijk zijn van vormgeheugeneffect Van planten afgeleide vluchtige stoffen kunnen dienen als toekomstige antischimmelmiddelen
Van planten afgeleide vluchtige stoffen kunnen dienen als toekomstige antischimmelmiddelen Proton heeft een hoge of lage lading?
Proton heeft een hoge of lage lading?  Bestaat er een chemische formule voor ammoniak en chloor?
Bestaat er een chemische formule voor ammoniak en chloor?  Die zal dissociëren wanneer deze in water wordt geplaatst. CH3OH b. HCl c. KBr d. HClO4?
Die zal dissociëren wanneer deze in water wordt geplaatst. CH3OH b. HCl c. KBr d. HClO4?
 Naarmate de klimaatverandering voortschrijdt, kunnen nieuwe regenpatronen planten over de hele wereld aantasten
Naarmate de klimaatverandering voortschrijdt, kunnen nieuwe regenpatronen planten over de hele wereld aantasten  Onderzoek:impact van beleid ter beheersing van kwik neemt af met elke vijf jaar vertraging
Onderzoek:impact van beleid ter beheersing van kwik neemt af met elke vijf jaar vertraging Hoe de neushoorn werkt
Hoe de neushoorn werkt Onderzoeker op zoek naar aanwijzingen in het mysterie van de watervoorziening van de Grand Canyons
Onderzoeker op zoek naar aanwijzingen in het mysterie van de watervoorziening van de Grand Canyons Greenpeace slaat alarm over plasticvervuiling in rivieren
Greenpeace slaat alarm over plasticvervuiling in rivieren
Hoofdlijnen
- Wat is de manier waarop de samenleving de wetenschap beheerst?
- De oranje vleugels en het DNA van de kroontjeswants:hoe de diëten van insecten worden onthuld door het genoom
- Kunnen insecten dik worden?
- Biochemisch 'fossiel' laat zien hoe leven zonder fosfaat zou kunnen zijn ontstaan
- Wat is het doel van een cross -functioneel team?
- Wat zijn de stadia van cytokinese?
- Studie benadrukt de impact van de invasie van koraalduivels in de Middellandse Zee
- Sociale vaardigheden van honden gekoppeld aan gevoeligheid voor oxytocine
- De Durian-industrie zou kunnen lijden zonder de bedreigde fruitvleermuis
- Moleculaire lijm maakt perovskiet-zonnecellen in de loop van de tijd aanzienlijk betrouwbaarder

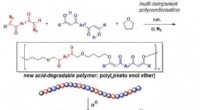
- Nieuw synthetisch polymeer afbreekbaar onder zeer milde zure omstandigheden
- Eiwitraket verhoogt kans op doorbraken van ziekten

- Studie onthult hoe zuurstofarm eiwit losjes bindt aan een mineraal
- Kunstmatige bladeren uit het lab de lucht in verplaatsen

 Onderzoekers creëren nieuwe staat van licht
Onderzoekers creëren nieuwe staat van licht Harddrive-boost wordt geleverd in lagen van ijzer en kobalt
Harddrive-boost wordt geleverd in lagen van ijzer en kobalt Hoe drijft de nieuwsgierigheid niet weg terwijl hij op Mars is?
Hoe drijft de nieuwsgierigheid niet weg terwijl hij op Mars is?  Statistische techniek voor het automatisch opschonen van foutieve gegevens van weerballonwaarnemingen
Statistische techniek voor het automatisch opschonen van foutieve gegevens van weerballonwaarnemingen Protonen zijn zoveel massiever dan elektronen dat je de massa kunt verwaarlozen bij het bepalen van een atoom?
Protonen zijn zoveel massiever dan elektronen dat je de massa kunt verwaarlozen bij het bepalen van een atoom?  Samen beter:mens- en robotmedewerkers efficiënter, minder ongevalsgevoelig
Samen beter:mens- en robotmedewerkers efficiënter, minder ongevalsgevoelig Hoe voorwaardelijke waarschijnlijkheden te berekenen
Hoe voorwaardelijke waarschijnlijkheden te berekenen
Voorwaardelijke kans is een term in waarschijnlijkheid en statistieken die betekent dat de ene gebeurtenis van de andere afhangt. U kunt bijvoorbeeld worden gevraagd om de kans te vinden om een
 Wat bevat bundels buisachtige cellen die water en voedsel vervoeren?
Wat bevat bundels buisachtige cellen die water en voedsel vervoeren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

