
Wetenschap
Is het typerend voor overgangsmetalen om isotopen te hebben?
* Atomische structuur: Overgangsmetalen bevinden zich in het midden van het periodiek systeem. Ze hebben een complexe elektronenconfiguratie met gedeeltelijk gevulde D-orbitalen. Dit betekent dat ze een relatief hoog aantal protonen in hun kern hebben.
* neutronenvariabiliteit: Het aantal neutronen in de kern van een atoom kan variëren, zelfs voor hetzelfde element. Deze variaties worden isotopen genoemd. Overgangsmetalen, met hun grote aantal protonen, hebben vaak meerdere manieren om de nucleaire krachten in evenwicht te brengen met verschillende aantallen neutronen.
Voorbeelden:
* ijzer (Fe): IJzer heeft vier stabiele isotopen:Iron-54, Iron-56, Iron-57 en Iron-58.
* koper (cu): Koper heeft twee stabiele isotopen:koper-63 en koper-65.
* Cobalt (CO): Cobalt heeft één stabiele isotoop, kobalt-59 en verschillende radioactieve isotopen.
Samenvattend: Overgangsmetalen zijn over het algemeen vatbaar voor het hebben van meerdere isotopen vanwege hun complexe atoomstructuur en het vermogen om het aantal neutronen in hun kern te variëren.
 Verschil tussen ammoniumsuffide en sulfiet?
Verschil tussen ammoniumsuffide en sulfiet?  Hoog-entropie-gestabiliseerde chalcogeniden met hoge thermo-elektrische prestaties
Hoog-entropie-gestabiliseerde chalcogeniden met hoge thermo-elektrische prestaties Nieuwe methode stimuleert de vorming van syngas uit biopolyolen
Nieuwe methode stimuleert de vorming van syngas uit biopolyolen Science Fair Project over het effect van koolzuurhoudende dranken op vlees
Science Fair Project over het effect van koolzuurhoudende dranken op vlees Wat is de natuurlijke bron van chloor?
Wat is de natuurlijke bron van chloor?
 Geowetenschappers leveren gegevens die suggereren dat wereldwijde klimaatveranderingen de riviererosie vergroten
Geowetenschappers leveren gegevens die suggereren dat wereldwijde klimaatveranderingen de riviererosie vergroten Verticale metingen van luchtverontreinigende stoffen in stedelijk Beijing
Verticale metingen van luchtverontreinigende stoffen in stedelijk Beijing Waarom de boommarter niet de beste vriend van elke rode eekhoorn is
Waarom de boommarter niet de beste vriend van elke rode eekhoorn is  Openbare database met opslagfaciliteiten voor mijnafval gelanceerd om damstoringen te voorkomen
Openbare database met opslagfaciliteiten voor mijnafval gelanceerd om damstoringen te voorkomen Voetbalveld regenwoud vernietigd elke zes seconden
Voetbalveld regenwoud vernietigd elke zes seconden
Hoofdlijnen
- Welke toestand in een experiment manipuleert een bioloog?
- Wat is het verschil tussen een mens en een fruitvlieg?
- Nieuwe techniek verbetert proteoform-beeldvorming in menselijk weefsel
- Hoe spiercellen hun membranen afsluiten
- Hoe de modulaire structuur van eiwitten ervoor zorgt dat de evolutie vooruitgaat
- Wat is het verschil tussen planten- en dierenmitose?
- Hoe E. coli de kracht krijgt om urineweginfecties te veroorzaken
- Wat gebeurt er met gentranscriptie tijdens DNA-schade?
- Nieuwe inzichten over hoe de vogelgriep de soortbarrière overschrijdt
- Single-particle spectroscopie van CsPbBr3-perovskiet onthult de oorsprong van lage elektrolumine

- De ontdekking van vloeibaar metaal luidt een nieuwe golf van chemie en elektronica in

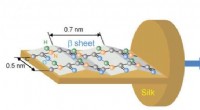
- Nieuwe infraroodbeeldvormingstechniek onthult moleculaire oriëntatie van eiwitten in zijdevezels
- Titaandioxide-sterren in onderzoek bij synchrotron in Krakau

- Wetenschappers vragen:hoe kunnen vloeibare organellen in cellen naast elkaar bestaan zonder te versmelten?
 Zijn akkoord met één cellen of meercellig?
Zijn akkoord met één cellen of meercellig?  Kunnen sociale interacties de verspreiding van ziekten beïnvloeden?
Kunnen sociale interacties de verspreiding van ziekten beïnvloeden? Immigranten en hun kinderen worden vaker geprofileerd voor burgerschap
Immigranten en hun kinderen worden vaker geprofileerd voor burgerschap Zinderende zomers in het zuidwesten kunnen binnen enkele seconden brandwonden veroorzaken op de stoep
Zinderende zomers in het zuidwesten kunnen binnen enkele seconden brandwonden veroorzaken op de stoep Biobased plastics kunnen afval verminderen, maar alleen als we investeren in het maken en wegwerken ervan
Biobased plastics kunnen afval verminderen, maar alleen als we investeren in het maken en wegwerken ervan Hoe heet het wanneer rotsen van hun oorspronkelijke locatie worden verplaatst?
Hoe heet het wanneer rotsen van hun oorspronkelijke locatie worden verplaatst?  Opinie:Waarom de verhoogde klimaatambitie van de scheepvaartsector het gebruik van fossiele brandstoffen zal verminderen
Opinie:Waarom de verhoogde klimaatambitie van de scheepvaartsector het gebruik van fossiele brandstoffen zal verminderen  Zeldzaam ijzeroxide kan worden gecombineerd met 2D-materialen voor elektronische, spintronische apparaten
Zeldzaam ijzeroxide kan worden gecombineerd met 2D-materialen voor elektronische, spintronische apparaten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

