
Wetenschap
Waarom is Cu meer reactief dan Zn?
* Elektronenconfiguratie: Zink heeft een elektronenconfiguratie van [AR] 3D¹⁰ 4S², terwijl koper een elektronenconfiguratie heeft van [AR] 3D¹⁰ 4S¹. Dit betekent dat zink twee valentie -elektronen in zijn buitenste schaal heeft, waardoor het gemakkelijker is om ze te verliezen en positieve ionen te vormen. Koper, met slechts één valentie -elektron, vereist meer energie om een elektron te verliezen.
* Elektrochemische serie: De elektrochemische serie rangschikt metalen op basis van hun neiging om elektronen te verliezen en kationen te vormen. Zink heeft een meer negatieve standaardelektrodepotentiaal (-0,76 V) in vergelijking met koper (+0,34 V). Dit geeft aan dat zink een grotere neiging heeft om elektronen te verliezen en daarom reactiever is.
Praktisch voorbeeld:
* Als u een stuk zinkmetaal in een oplossing van kopersulfaat steekt, zal het zink de koperionen uit de oplossing verplaatsen, zinksulfaat vormen en koperen metaal op het zinkoppervlak afzetten. Dit is een duidelijke demonstratie van de hogere reactiviteit van Zink.
Samenvattend:
De grotere reactiviteit van Zink komt voort uit zijn elektronenconfiguratie, waardoor het gemakkelijk elektronen kan verliezen, en zijn meer negatieve standaardelektrodepotentiaal, wat duidt op een sterkere neiging om positieve ionen te vormen.
 Onderzoekers bootsen twee natuurlijke energieprocessen na met een enkele katalysator
Onderzoekers bootsen twee natuurlijke energieprocessen na met een enkele katalysator Is het een vaste vloeistof of gas van een personen?
Is het een vaste vloeistof of gas van een personen?  Spontaan patronen creëren in synthetische materialen
Spontaan patronen creëren in synthetische materialen Wat is de juiste volgorde van de kookpunten van hoog naar laag voor een koolwaterstof, een alcoholcarbonzuur en een ester?
Wat is de juiste volgorde van de kookpunten van hoog naar laag voor een koolwaterstof, een alcoholcarbonzuur en een ester?  Welke producten zijn gemaakt van zuur?
Welke producten zijn gemaakt van zuur?
 As You Go Dieper in the Earth Wat gebeurt er met de dichtheid van de lagen?
As You Go Dieper in the Earth Wat gebeurt er met de dichtheid van de lagen?  Het krimpen van de Groenlandse gletsjers begon te versnellen in 2000, onderzoek vindt
Het krimpen van de Groenlandse gletsjers begon te versnellen in 2000, onderzoek vindt Fijnstof van natuurbrandrook schadelijker dan vervuiling uit andere bronnen
Fijnstof van natuurbrandrook schadelijker dan vervuiling uit andere bronnen Science Fair Project voor het testen van verschillende bodems met plantengroei
Science Fair Project voor het testen van verschillende bodems met plantengroei IJsvrije Arctische zomers kunnen aan de eerdere kant van voorspellingen gebeuren
IJsvrije Arctische zomers kunnen aan de eerdere kant van voorspellingen gebeuren
Hoofdlijnen
- Welke wetenschapper vergelijkt gegevens van haar controlegroep en experimenteel welke wetenschappelijke methode uitvoert ze?
- Hoe je hersenen werken
- Cytoplasma dat de kern van een neuron omringt?
- Hoe zijn wetenschapstechnologie en samenleving allemaal gerelateerd?
- Epitheliale cellen: definitie, functie, typen en voorbeelden
- Bepaling van allelfrequenties
- Tot een hoogtepunt komen:hoe gewervelde dieren roofdieren werden door de neurale lijst aan te passen
- Is recessief allel degene die verborgen is wanneer dominant aanwezig is?
- Reduceren, hergebruiken, reflycleeren:hoe genetisch gemodificeerde vliegen afval kunnen verminderen en uit de stortplaatsen kunnen houden
- Moleculair viroloog bestrijdt griep op moleculair niveau

- Nieuwe benadering van zachte materiaalstroom kan plaats maken voor nieuwe materialen, ramp voorspelling

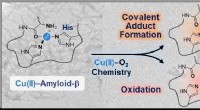
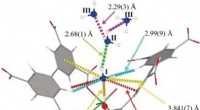
- Coördinatiechemie en de ziekte van Alzheimer
- Een robuust materiaal voor de opname en opslag van ammoniak met dichtheden die dicht bij die van het vloeibaar gemaakte gas liggen
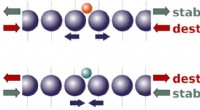
- Nieuwe theorie laat zien hoe spanning zorgt voor betere katalysatoren
 Hoe beïnvloedt klimaatverandering biodiversiteit?
Hoe beïnvloedt klimaatverandering biodiversiteit?  Drone-tests vinden een aantal verhoogde verontreinigende stoffen in de legerfabriek
Drone-tests vinden een aantal verhoogde verontreinigende stoffen in de legerfabriek Wat kan albatrospoep ons vertellen over klimaatverandering?
Wat kan albatrospoep ons vertellen over klimaatverandering? Venus in kaart brengen:extreme make-over of platentektoniek?
Venus in kaart brengen:extreme make-over of platentektoniek?  Zink reguleert de opslag en afgifte van neurotransmitters
Zink reguleert de opslag en afgifte van neurotransmitters De lengte van de zijkant van een driehoek vinden als u de andere twee zijden kent
De lengte van de zijkant van een driehoek vinden als u de andere twee zijden kent Wanneer zie je Venus in volle fase?
Wanneer zie je Venus in volle fase?  Het voorspellen van migratieroutes van muilezelherten zonder GPS-halsbanden
Het voorspellen van migratieroutes van muilezelherten zonder GPS-halsbanden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

