
Wetenschap
Waarom zijn geen twee emissiespectra voor verschillende elementen ooit hetzelfde?
* Elektronenergieniveaus: Atomen hebben specifieke energieniveaus die elektronen kunnen bezetten. Deze niveaus zijn gekwantiseerd, wat betekent dat elektronen alleen kunnen bestaan bij bepaalde discrete energiewaarden.
* opgewonden staten: Wanneer een atoom energie absorbeert (bijvoorbeeld warmte of licht), springt een elektron naar een hoger energieniveau. Dit wordt een opgewonden toestand genoemd.
* emissie: Wanneer het opgewonden elektron terugkeert naar een lager energieniveau, geeft het de geabsorbeerde energie vrij als een foton van licht. Het energieverschil tussen de twee niveaus bepaalt de golflengte van het uitgezonden licht.
* unieke "vingerafdrukken": Elk element heeft een unieke opstelling van energieniveaus. Dit betekent dat de energieverschillen tussen niveaus, en daarom de golflengten van uitgestraald licht, ook uniek zijn voor dat element.
Denk er zo aan:
* Stel je voor dat elk element een specifieke trap heeft, elke stap die een energieniveau vertegenwoordigt.
* Het hoogteverschil tussen de stappen bepaalt de energie van het licht dat wordt uitgestoten wanneer een elektron ertussen beweegt.
* Aangezien elk element zijn eigen unieke "trap" heeft, zal het uitgestoten licht ook uniek zijn.
Daarom produceert elk element een uniek patroon van gekleurde lijnen (emissiespectrum) dat overeenkomt met de specifieke energieverboorzers van zijn elektronen. Hierdoor kunnen we elementen identificeren op basis van hun emissiespectra.
Hoofdlijnen
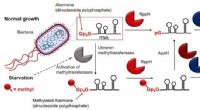
- Hoe de verkeerde genen worden onderdrukt
- Als de contractiele vacuole niet meer werkt, zal het organisme afsterven, wat gebeurt er in de cel?
- Neuronen die signalen van het centrale zenuwstelsel naar het skelet transporteren, maken deel uit van dit systeem?
- Hoe E. coli de kracht krijgt om urineweginfecties te veroorzaken
- Kolonies in verval:wat veroorzaakt de massale sterfte van honingbijen?
- Waar zijn ribosomen op geconstrueerd?
- Hoe helpen bacteriën in de leerindustrie?
- Welke stap is niet bereikt door wetenschappers die de oorsprong van het leven bestuderen?
- Evolueren parasieten om geslachtsverschillen in gastheren te exploiteren?
- Wat moeten we doen met plastic voor eenmalig gebruik?

- Sjabloon om superatomen te maken kan zorgen voor betere batterijen

- Een veelbelovende strategie om de activiteit in antimicrobiële peptiden te verhogen
- In het laboratorium gemaakte eiwit chomps co-factor als een grote ol gator
- Ontdekking van geheel nieuwe klasse RNA-caps in bacteriën
 Nieuw bewijs helpt bij het vormen van digitale reconstructie van het belangrijkste middeleeuwse heiligdom
Nieuw bewijs helpt bij het vormen van digitale reconstructie van het belangrijkste middeleeuwse heiligdom Hoe zwarte gaten werken
Hoe zwarte gaten werken  Onderzoek toont aan hoe cranberrysap bacteriën op moleculair niveau bestrijdt
Onderzoek toont aan hoe cranberrysap bacteriën op moleculair niveau bestrijdt  De meeste mensen overwegen om vegetariër te worden vanwege hun gezondheid
De meeste mensen overwegen om vegetariër te worden vanwege hun gezondheid Speekseleiwitten kunnen verklaren waarom sommige mensen te veel zout gebruiken
Speekseleiwitten kunnen verklaren waarom sommige mensen te veel zout gebruiken Variabele emissie van het superzware zwarte gat van de Melkweg
Variabele emissie van het superzware zwarte gat van de Melkweg Hoe ontdek je een nieuwe soort wolk – een gids voor luchtspotters
Hoe ontdek je een nieuwe soort wolk – een gids voor luchtspotters Undergrad publiceert theorie over immuundisfunctie in de ruimte
Undergrad publiceert theorie over immuundisfunctie in de ruimte
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


