
Wetenschap
Wat is de oxidatietoestand van zilver in oplossing?
In zilvernitraat (AgNO3), een gewoon zilverzout, heeft het zilverion bijvoorbeeld een oxidatietoestand van +1. Dit komt omdat het nitraation (NO3-) een lading van -1 heeft en de verbinding als geheel neutraal moet zijn. Daarom moet het zilverion een positieve lading hebben om de negatieve lading van het nitraation in evenwicht te brengen.
Op dezelfde manier hebben de zilverionen in zilversulfaat (Ag2SO4) ook een oxidatietoestand van +1. In dit geval heeft elk sulfaation (SO42-) een lading van -2, en aangezien er voor elk sulfaation twee zilverionen zijn, moeten de zilverionen elk een lading van +1 hebben om de totale lading van de verbinding in evenwicht te brengen.
Het is vermeldenswaard dat zilver ook verschillende oxidatietoestanden kan vertonen in bepaalde verbindingen of complexen, zoals +2 of zelfs hoger in sommige zeldzame gevallen. De +1 oxidatietoestand is echter de meest voorkomende en meest voorkomende vorm van zilver in oplossing.
 Eigenschappen van thermische isolatoren
Eigenschappen van thermische isolatoren Hoe lactoferrine de vrij rondlopende ijzerionen klemt om schadelijke effecten op cellen te stoppen
Hoe lactoferrine de vrij rondlopende ijzerionen klemt om schadelijke effecten op cellen te stoppen Onderzoek breidt onze kennis uit over natuurlijke, goedkope manieren om verontreinigende stoffen uit water te verwijderen
Onderzoek breidt onze kennis uit over natuurlijke, goedkope manieren om verontreinigende stoffen uit water te verwijderen  Is CH4 een niet-polaire covalente binding?
Is CH4 een niet-polaire covalente binding?  Groen materiaal voor koeling geïdentificeerd
Groen materiaal voor koeling geïdentificeerd
 Ecologie bevooroordeeld tegen niet-inheemse soorten?
Ecologie bevooroordeeld tegen niet-inheemse soorten?  Hoe filosofie jouw midlifecrisis kan oplossen
Hoe filosofie jouw midlifecrisis kan oplossen  Hittegolven in de oceaan verwoesten dieren in het wild, erger om te komen
Hittegolven in de oceaan verwoesten dieren in het wild, erger om te komen Onderzoek naar kustoverstromingen vindt vertrouwensopbouw, machtsdelingssleutel voor milieurechtvaardigheid
Onderzoek naar kustoverstromingen vindt vertrouwensopbouw, machtsdelingssleutel voor milieurechtvaardigheid Orkaancategorieën begrijpen:wat betekent categorie 1?
Orkaancategorieën begrijpen:wat betekent categorie 1?
Hoofdlijnen
- De vondst van zijn leven:8-jarige jongen ontdekt gigantische haaientand in South Carolina
- Inzicht in hoe cellen reageren op fysieke signalen zou tot nieuwe ziektebehandelingen kunnen leiden
- Onderzoekers tonen aan dat de lengte van telomeren de levensverwachting in het wild voorspellen
- Turkije bevrijdt 7, 500 illegaal opgejaagde kikkers de rivier in
- Vroegwaarschuwingssysteem voor veranderingen in het milieu:nieuwe dierenlabels met camera's en AI volledige eerste vlucht
- Wat zijn enkele kenmerken van proteïne?
- Voordelen en nadelen van klonen
- Nieuwe high-throughput sequencing-technologieën onthullen een wereld van op elkaar inwerkende micro-organismen
- Hielden dinosaurussen hun hoofd omhoog?
- Hoe maak je zout water beter schoon? Door ontziltingsgereedschappen droog te houden
- Induced-fit adsorbens voor acetyleen
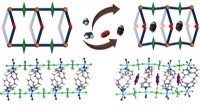
- Chemici creëren nieuwe route naar PHA's:natuurlijk afbreekbare bioplastics

- Het manipuleren van aardse materialen om de energie van de zon te benutten

- Atomair dunne perovskieten boost voor toekomstige elektronica

 Wetenschappers voorspellen de toekomst van de met ijs bedekte oceanen van de aarde aan hun harde randen
Wetenschappers voorspellen de toekomst van de met ijs bedekte oceanen van de aarde aan hun harde randen Methode voor het maken van optisch actieve polymeren met behulp van een spiraalvormig vloeibaar-kristalsjabloon
Methode voor het maken van optisch actieve polymeren met behulp van een spiraalvormig vloeibaar-kristalsjabloon UCF verkoopt experimenteel Marsvuil - $ 20 per kilogram, plus verzending
UCF verkoopt experimenteel Marsvuil - $ 20 per kilogram, plus verzending Het simuleren van diffusie met behulp van kinosonen en machinaal leren
Het simuleren van diffusie met behulp van kinosonen en machinaal leren  De 10 langste bruggen ter wereld
De 10 langste bruggen ter wereld  Universiteiten kunnen meer doen om hun studenten met een handicap te ondersteunen
Universiteiten kunnen meer doen om hun studenten met een handicap te ondersteunen  Waarom zijn sommige gassen zwaarder dan andere?
Waarom zijn sommige gassen zwaarder dan andere?  Soorten gravende dieren
Soorten gravende dieren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

