
Wetenschap
Hoe zijn alkali -metalen tot edelgassen?
Alkali -metalen:
* Elektronenconfiguratie: Heb één valentie -elektron in hun buitenste schaal.
* Reactiviteit: Zeer reactief, gemakkelijk hun enkele valentie -elektron verliezen om +1 kationen te vormen.
* Fysieke eigenschappen: Zacht, zilver en hebben lage smelt- en kookpunten.
* chemische eigenschappen: Reageer krachtig met water om hydroxiden en waterstofgas te vormen.
* Voorbeelden: Lithium (Li), Natrium (NA), Kalium (K), Rubidium (RB), Cesium (CS), Francium (FR).
Nobele gassen:
* Elektronenconfiguratie: Heb een volledige buitenste schaal van elektronen (meestal 8 elektronen, behalve helium, die 2 heeft).
* Reactiviteit: Zeer niet -reactief vanwege hun stabiele elektronenconfiguraties. Ze vormen zelden chemische bindingen.
* Fysieke eigenschappen: Kleurloos, reukloos en bestaan als gassen bij kamertemperatuur.
* chemische eigenschappen: Over het algemeen inert (niet-reactief), maar kan verbindingen vormen onder extreme omstandigheden.
* Voorbeelden: Helium (HE), Neon (NE), Argon (AR), Krypton (KR), Xenon (XE), Radon (RN).
Relatie:
Alkali -metalen en edelgassen vertegenwoordigen twee uitersten in reactiviteit. Alkali -metalen zijn zeer reactief vanwege hun wens om hun enkele valentie -elektron te verliezen en een stabiele edelgasconfiguratie te bereiken. Aan de andere kant hebben edelgassen al een stabiele elektronenconfiguratie, waardoor ze extreem niet -reactief zijn.
Belangrijkste verschillen in samenvatting:
| Feature | Alkali metalen | Edelgassen |
| --------------- | --------------- | ------------- |
| Reactiviteit | Hoog | Zeer laag |
| Elektronenconfiguratie | 1 valentie -elektron | Volledige buitenste schaal |
| Fysieke toestand | Solid (behalve Francium) | Gas |
| Chemische binding | Vorm gemakkelijk ionische bindingen | Zelden vormen bindingen |
Hoewel zowel alkali -metalen als edelgassen verschillende posities op het periodieke tabel innemen, zijn ze daarom fundamenteel verschillend in hun chemische en fysische eigenschappen. De contrasterende elektronenconfiguraties stimuleren deze verschillen.
 Wat is het totale aantal elektronen in p-orbitalen van een palladiumatoom in zijn grondtoestand?
Wat is het totale aantal elektronen in p-orbitalen van een palladiumatoom in zijn grondtoestand?  Waarom worden lipiden pseudomacromoleculen genoemd?
Waarom worden lipiden pseudomacromoleculen genoemd?  Acid Base Titration Theory
Acid Base Titration Theory  Effectief materiaal ontwikkeld om postoperatieve hechting te voorkomen
Effectief materiaal ontwikkeld om postoperatieve hechting te voorkomen Hoe verschilt de zuurconcentratie van de sterkte van een zuur?
Hoe verschilt de zuurconcentratie van de sterkte van een zuur?
Hoofdlijnen
- Welke receptorcellen stellen ons het meest direct in staat om verschillende golflengten van licht te onderscheiden?
- Veel bacteriën kunnen zich niet reproduceren bij koelere temperaturen en worden hoog vernietigd. Hoe profiteren mensen van dit feit bij het bereiden van het opslaan van voedsel?
- Hoe is de membraanpermeabiliteit?
- Waarom hebben ciliaten twee kernen?
- Hoe verhindert de afwezigheid van een nucleaire envelop in prokaryoten de controle van genexpressie door RNA na transcriptie te modificeren?
- Onderzoekers ontdekken details over hoe bacteriën beschermende barrières bouwen, wat nieuwe antibiotica kan opleveren
- Motoreiwitten vervoeren kostbare lading in neuronen. Hoe kunnen we hun beweging controleren?
- Hoe zijn schimmel en protisten gunstig voor ons?
- Zijn 'hondenjaren' echt? Een uitleg over het berekenen van de leeftijd van honden
- Nieuwe katalysatormethode belooft beter gebruik van syngas, steenkool

- Nieuwe manier om nanomaterialen krachtiger te maken voor elektronische toepassingen
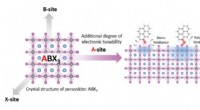
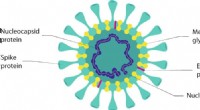
- Antivirale oppervlakken, oppervlaktecoatings en hun werkingsmechanismen
- Techniek om keramische films te fabriceren voor OPV-tussenlagen

- Elektrochemische synthese nu mogelijk zonder elektrische stroombron

 Wat zijn enkele veiligheidsproblemen met chloor 36?
Wat zijn enkele veiligheidsproblemen met chloor 36?  Nieuw inzicht in hoe de krachtcentrale van cellen zich deelt
Nieuw inzicht in hoe de krachtcentrale van cellen zich deelt  Studie werpt licht op de ontwikkeling van nieuwe tegengiffen tegen zenuwgassen
Studie werpt licht op de ontwikkeling van nieuwe tegengiffen tegen zenuwgassen  Passende lichaamsbeweging is een belangrijk onderdeel van de gezondheid van de bemanning tijdens ruimtemissies
Passende lichaamsbeweging is een belangrijk onderdeel van de gezondheid van de bemanning tijdens ruimtemissies  Hoeveel centimeter is 91 centimeter?
Hoeveel centimeter is 91 centimeter?  Archeologen ontdekken oud handelsnetwerk in Vietnam
Archeologen ontdekken oud handelsnetwerk in Vietnam Circulaire wateroplossingen toepassen van India tot Zweden
Circulaire wateroplossingen toepassen van India tot Zweden Brandwerend tropisch woud op de rand van verdwijning
Brandwerend tropisch woud op de rand van verdwijning
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

