
Wetenschap
Als 5.50 mol butaan wordt gereageerd, hoeveel watermolie waterdamp geproduceerd?
Hier is hoe dit probleem op te lossen:
1. Schrijf de gebalanceerde chemische vergelijking voor de verbranding van butaan:
C₄h₁₀ (g) + 13/2 o₂ (g) → 4 co₂ (g) + 5 h₂o (g)
2. Bepaal de molverhouding tussen butaan en water:
Uit de evenwichtige vergelijking zien we dat 1 mol butaan (c₄h₁₀) 5 mol water produceert (H₂o).
3. Bereken de geproduceerde mol water:
Omdat we 5,50 mol butaan hebben en de molverhouding 1:5 is, kunnen we de mol water berekenen:
5.50 mol C₄h₁₀ * (5 mol H₂o / 1 mol c₄h₁₀) = 27,5 mol H₂o
Daarom zal 27,5 mol waterdamp worden geproduceerd wanneer 5.50 mol butaan wordt gereageerd.
 NASA-onderzoek naar supercomputers breekt terrein voor het in kaart brengen van bomen, koolstofonderzoek
NASA-onderzoek naar supercomputers breekt terrein voor het in kaart brengen van bomen, koolstofonderzoek Pesticiden gevonden in meer dan 80% van de geteste Europese bodems
Pesticiden gevonden in meer dan 80% van de geteste Europese bodems Mineraalrijke zeebodem en DDT-stortplaatsen onthullen nieuwe methaansijpeling, walvis vallen
Mineraalrijke zeebodem en DDT-stortplaatsen onthullen nieuwe methaansijpeling, walvis vallen De impact van klimaatrisico's op het financiële systeem beoordelen
De impact van klimaatrisico's op het financiële systeem beoordelen Studie toont universeel positief effect van bodembedekkers op bodemmicrobioom
Studie toont universeel positief effect van bodembedekkers op bodemmicrobioom
Hoofdlijnen
- Waarom herkristalliseert ghb?
- Desinformatie over gezondheid is wijdverbreid op sociale media. Dit is wat het doet, waarom het zich verspreidt en mensen er iets aan kunnen doen
- Wat is de samenstellende vorm van AB?
- Waar komt de kleur vandaan in paarse kool?
- Welke twee dingen zouden met dieren gebeuren als er geen fotosynthese was?
- Onderzoekers bieden visserij een oplossing voor overbevissing
- De studie van menselijke biologie binnen de raamwerk -evolutie kan worden gezegd dat het domein van is?
- Hoe wordt op zichzelf bestuivingen genoemd?
- Uit hoeveel basenparen bestaan echte menselijke chromosomen?
- Wereldprimeur voor het lezen van digitaal gecodeerde synthetische moleculen
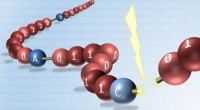
- Zelfvernietigde redox-gevoelige stomatocyt nanomotor levert en geeft medicijnen vrij voor cellen
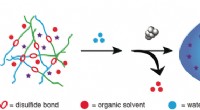
- Directe methaanomzetting onder milde omstandigheden door thermo-, elektro- of fotokatalyse beoordeeld

- Wetenschappers melden een nieuwe cascadereactie

- Onderzoekers ontwikkelen baanbrekend proces om kankerverwekkende medicijnen te maken
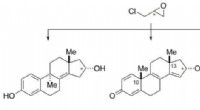
 Hoe definiëren wetenschappers massa?
Hoe definiëren wetenschappers massa?  Meerdere afbeeldingen in een advertentie gebruiken? Verschillende perspectieven kunnen consumenten in verwarring brengen
Meerdere afbeeldingen in een advertentie gebruiken? Verschillende perspectieven kunnen consumenten in verwarring brengen  Hoe wordt de afstand tussen de toppen van golven genoemd?
Hoe wordt de afstand tussen de toppen van golven genoemd?  Een nieuwe behandeling voor een hartinfarct maakt gebruik van nanoblaasjes om de immuunrespons te moduleren
Een nieuwe behandeling voor een hartinfarct maakt gebruik van nanoblaasjes om de immuunrespons te moduleren  Milieubescherming in de ruimte
Milieubescherming in de ruimte Deep learning verovert Saturnus stormenderhand
Deep learning verovert Saturnus stormenderhand Computer doorzoekt telescoopgegevens op sporen van verre planeten
Computer doorzoekt telescoopgegevens op sporen van verre planeten Hoe wordt regen gevormd?
Hoe wordt regen gevormd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

