
Wetenschap
Welk type ionen vormen niet -metalen?
Dit is waarom:
* Elektronenconfiguratie: Niet -metalen hebben meestal bijna volledige buitenste elektronenschalen. Om een stabiele elektronenconfiguratie te bereiken, zoals die van edelgassen, krijgen ze elektronen.
* elektronegativiteit: Niet -metalen hebben een hogere elektronegativiteit dan metalen. Dit betekent dat ze een sterkere aantrekkingskracht hebben op elektronen.
Wanneer een niet -metaal elektronen wint, wordt het negatief geladen omdat het nu meer elektronen heeft dan protonen. Deze negatieve lading maakt het een anion.
Voorbeelden van niet -metalen anionen:
* Chloride -ion (Cl⁻)
* Oxide -ion (o²⁻)
* Nitride -ion (n³⁻)
* Sulfide -ion (S²⁻)
* Fluoride -ion (f⁻)
 Wat doet natriumcitraat bij DNA-extractie?
Wat doet natriumcitraat bij DNA-extractie?  Morsen in een nucleaire faciliteit toont potentiële brandwondenrisico's van een huishoudelijke chemische stof
Morsen in een nucleaire faciliteit toont potentiële brandwondenrisico's van een huishoudelijke chemische stof Kleine robot kan game-changer zijn in de strijd tegen tuberculose
Kleine robot kan game-changer zijn in de strijd tegen tuberculose Wat zijn de elementen die thuishoren in de halogeenelementenfamilie?
Wat zijn de elementen die thuishoren in de halogeenelementenfamilie?  Hoe Atomen in Gram te converteren
Hoe Atomen in Gram te converteren
 Onderzoekers vinden wolken gevuld met ijslolly's
Onderzoekers vinden wolken gevuld met ijslolly's India's droogperiode van 50 jaar en daaropvolgende omkering - strijd tussen natuurlijke en antropogene variabiliteit
India's droogperiode van 50 jaar en daaropvolgende omkering - strijd tussen natuurlijke en antropogene variabiliteit Welke geheimen van de zwaartekracht zijn de afgelopen 50 jaar ontdekt?
Welke geheimen van de zwaartekracht zijn de afgelopen 50 jaar ontdekt?  Bijna een derde van de moerassen van Mobile Bay verdwenen sinds de jaren 80, studie vondsten
Bijna een derde van de moerassen van Mobile Bay verdwenen sinds de jaren 80, studie vondsten Analyse van gegevensbronnen verbetert het vermogen om te reageren op klimaatverandering in Oost-Afrika
Analyse van gegevensbronnen verbetert het vermogen om te reageren op klimaatverandering in Oost-Afrika
Hoofdlijnen
- Wat zijn de juiste reeksen gebeurtenissen in productie -recombinant DNA?
- Een model dat bekend staat als een wat gebruikt DNA -vergelijkingen om te schatten de tijdsduur die soorten onafhankelijk zijn geëvolueerd?
- Zwarte wolven:de eerste genetisch gemodificeerde roofdieren?
- Wetenschappers tonen positieve effecten aan van een beleid van positieve discriminatie ter bevordering van vrouwen
- Wat is recombinatie?
- Feiten over de Spleen
- Wat zijn de verschillende mogelijke gevolgen van overproductie nakomelingen?
- Top 10 mythes over de hersenen
- Hoe ballistische valkaakmieren zelfvernietiging voorkomen met een perfecte onderkaakboog
- Onderzoekers ontdekken niet eerder onderzocht kankerenzym

- Een nieuwe vloeibare kristalinkt voor 3D-printen
- Plastic afbreken in zijn samenstellende delen
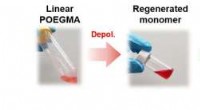
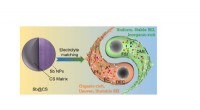
- Het bereiken van stabiele K-opslagprestaties van met koolstofbolletjes opgesloten antimoon via elektrolytregulatie
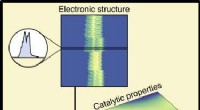
- Machine learning verbindt materiaalsamenstelling en prestaties in katalysatoren
 Wat gebeurt er met een plantencel in een zoutoplossing?
Wat gebeurt er met een plantencel in een zoutoplossing?  Verminderen zorgen over klimaatverandering de kinderwens?
Verminderen zorgen over klimaatverandering de kinderwens? Traditionele stadscentra zijn in veel Amerikaanse steden dood of stervende. Wat is de toekomst voor deze zones?
Traditionele stadscentra zijn in veel Amerikaanse steden dood of stervende. Wat is de toekomst voor deze zones?  Gegevens bevestigen groeiende dode zone in Chesapeake Bay
Gegevens bevestigen groeiende dode zone in Chesapeake Bay Werkgevers moeten nu handelen om hybride werken tot een succes te maken in Noord-Engeland
Werkgevers moeten nu handelen om hybride werken tot een succes te maken in Noord-Engeland 80% van het huishoudelijk water wordt verspild
80% van het huishoudelijk water wordt verspild Insectenbeetsporen tonen het eerste fossiele bewijs dat de bladeren van planten zich 's nachts opvouwen
Insectenbeetsporen tonen het eerste fossiele bewijs dat de bladeren van planten zich 's nachts opvouwen  Boek onderzoekt ruig individualisme en de impact ervan op ongelijkheid in Amerika
Boek onderzoekt ruig individualisme en de impact ervan op ongelijkheid in Amerika
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

