
Wetenschap
Welk effect had de toevoeging van suiker aan beker B en Salt C op het vriespuntwater in deze bekers?
* Freezing Point Depression: De toevoeging van opgeloste stoffen (zoals suiker of zout) aan een oplosmiddel (zoals water) verlaagt het vriespunt van de oplossing. Dit fenomeen staat bekend als de depressie van het vriespunt.
* Verstoring van watermoleculen: Wanneer suiker of zout oplost in water, verstoren de opgeloste moleculen de waterstofbinding tussen watermoleculen. Dit maakt het voor de watermoleculen moeilijker om de reguliere kristallijne structuur te vormen die nodig is om te bevriezen.
* concentratie is belangrijk: Hoe meer opgeloste stof u toevoegt (hogere concentratie), hoe groter het vriespuntdepressie. Dus een beker met veel suiker of zout heeft een lager vriespunt dan een met een kleinere hoeveelheid.
Praktisch voorbeeld: Daarom zout wegen in de winter! Het zout lost op in de sneeuw of het ijs, waardoor het vriespunt wordt verlaagd en het zelfs bij temperaturen onder 0 ° C (32 ° F) laat smelten.
 Is deze zin waar of niet waar? Lava koelt snel af en vormt mineralen met kleine kristallen?
Is deze zin waar of niet waar? Lava koelt snel af en vormt mineralen met kleine kristallen?  Hoe worden oxidatiereductiereacties gebruikt in het dagelijks leven?
Hoe worden oxidatiereductiereacties gebruikt in het dagelijks leven?  Welk element in groep één heeft een hoger atoomnummer dan chloor, maar lager broom?
Welk element in groep één heeft een hoger atoomnummer dan chloor, maar lager broom?  Wanneer is water een opgeloste stof?
Wanneer is water een opgeloste stof?  Welke verbinding wordt gevormd met chloor en zink?
Welke verbinding wordt gevormd met chloor en zink?
 Het kwantificeren van de ecosysteemdiensten van gletsjers benadrukt hun belang voor de mensheid
Het kwantificeren van de ecosysteemdiensten van gletsjers benadrukt hun belang voor de mensheid Datamining om de waterkwaliteit in het zuidoosten van Ohio te beschermen
Datamining om de waterkwaliteit in het zuidoosten van Ohio te beschermen Coronavirus werpt schaduw over Everest
Coronavirus werpt schaduw over Everest Hoe een Raven Feather
Hoe een Raven Feather Het laguneparadijs van Mar Menor in Spanje spuugt tonnen dode vissen uit
Het laguneparadijs van Mar Menor in Spanje spuugt tonnen dode vissen uit
Hoofdlijnen
- Hoe behoudt een cel zijn identiteit tijdens replicatie?
- Deze kleine ouders van koraalrifvissen beslissen wanneer hun embryo's uitkomen
- Wat is bioaccumulantia?
- Bijen zijn verbazingwekkend goed in het nemen van beslissingen – en ons computermodel legt uit hoe dat mogelijk is
- Het ontrafelen van een mysterie in de 'histonecode' laat zien hoe genactiviteit wordt geërfd
- Welke organel biedt ondersteuning voor kleine planten?
- Gistonderzoek biedt een mogelijk antwoord op de vraag waarom sommige soorten generalisten zijn en andere specialisten
- Wat is de eigenaardigheid van structuur -DNA?
- Hoe leeuwenbekken hun kleur behouden:bewegwijzeringstruc onthult evolutionair mechanisme
- Blauw-emitterende diode demonstreert beperkingen en belofte van perovskiet-halfgeleiders
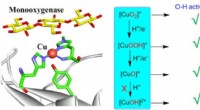
- Theoretisch perspectief op C-H/O-H activering door Cu-O in biologische en synthetische systemen
- AI-aangedreven elektronische neus om de versheid van vlees te ruiken

- Loodhalogenideperovskieten zijn niet ferro-elektrisch

- Met deze nieuwe alfa-gel, de crème van alle huidcrèmes zou hier kunnen zijn

 Sterren maken toen het heelal half zo oud was
Sterren maken toen het heelal half zo oud was Hoe een ontevreden wetenschapper wilde bewijzen dat zijn voedsel niet nieuw ontdekte radioactieve tracers was en de Nobelprijs won
Hoe een ontevreden wetenschapper wilde bewijzen dat zijn voedsel niet nieuw ontdekte radioactieve tracers was en de Nobelprijs won  Kan een mier werknemer van de maand zijn?
Kan een mier werknemer van de maand zijn?  DNA-nanostructuren die zijn ontworpen voor medicijnafgifte blijven een technische uitdaging
DNA-nanostructuren die zijn ontworpen voor medicijnafgifte blijven een technische uitdaging Als eersten wij astronauten op de maan?
Als eersten wij astronauten op de maan?  Wat is het abstracte zelfstandig naamwoord voor intuïtief?
Wat is het abstracte zelfstandig naamwoord voor intuïtief?  De vraag van één partij versus derde partij:hoe merken de uitdagingen van verkopen via online platforms aanpakken
De vraag van één partij versus derde partij:hoe merken de uitdagingen van verkopen via online platforms aanpakken Op jacht naar giftige stoffen in slib
Op jacht naar giftige stoffen in slib
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

