
Wetenschap
Bindingen zijn polair wanneer het verschil in elektronegatief van atomen dan 1,7 is. Met één atoomtekent naar zichzelf?
bindingen zijn polair wanneer het verschil in elektronegativiteit van atomen is groter dan 1.7, met één atoomteken elektronen naar zichzelf.
Dit is waarom:
* elektronegativiteit: Dit is een maat voor het vermogen van een atoom om elektronen in een binding aan te trekken. Atomen met hogere elektronegativiteit zullen elektronen dichter bij zichzelf trekken.
* Polaire bindingen: Wanneer er een significant verschil is in elektronegativiteit tussen twee atomen, worden de elektronen niet gelijk gedeeld. Dit creëert een gedeeltelijke positieve lading op het minder elektronegatieve atoom en een gedeeltelijke negatieve lading op het meer elektronegatieve atoom.
* De 1.7 drempel: Hoewel de 1.7 -waarde een algemeen aangehaalde richtlijn is, is het belangrijk om te begrijpen dat het geen strikte cutoff is. Sommige bronnen gebruiken iets verschillende waarden. Het belangrijkste punt is dat een groter verschil in elektronegativiteit leidt tot een meer polaire binding.
Voorbeeld:
In een watermolecuul (H₂O) heeft zuurstof een hogere elektronegativiteit dan waterstof. Dit creëert een polaire binding, waarbij zuurstof een gedeeltelijke negatieve lading heeft (Δ-) en elke waterstof met een gedeeltelijke positieve lading (Δ+).
Laat het me weten als je nog andere chemische vragen hebt!
 Hoe een Microgrid werkt
Hoe een Microgrid werkt Kansas goed eigenaren, eigenaren van niet-bronnen hebben verschillende bewateringsroutines tijdens droogte
Kansas goed eigenaren, eigenaren van niet-bronnen hebben verschillende bewateringsroutines tijdens droogte Geowetenschappers gebruiken zirkoon om de oorsprong van de continenten van de aarde te traceren
Geowetenschappers gebruiken zirkoon om de oorsprong van de continenten van de aarde te traceren In rampen wakker, nieuwe computertechnieken ondersteunen hulpdiensten
In rampen wakker, nieuwe computertechnieken ondersteunen hulpdiensten Wetenschapsprojecten met overstromingsmodellen
Wetenschapsprojecten met overstromingsmodellen
Hoofdlijnen
- Gedetailleerd overzicht van oude Britse vogels onthult potentiële kandidaten voor herwildering
- Welke definitie voor (s) in de natuurwetenschappen?
- Bloem of vlees? Genetica verklaart de voorkeur van muggen
- Waar bevindt het amylase -enzym zich?
- Wat heeft een celmembraan dat het voor bepaalde moleculen gemakkelijker maakt om het membraan over te steken?
- Luie valsspeler leeft onder de grond,
- Wat is de gramreactie van niet-zuur-snelle bacteriën?
- Wat zijn de voedselproductiestructuren van een plantencel?
- Wat is S-fase van interfase?
- DNA buigen kost minder energie dan aangenomen
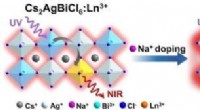
- Efficiënte nabij-infrarode luminescentie in met lanthanide gedoteerde, volledig anorganische halide dubbele perovskieten
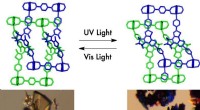
- Nieuw flexibel materiaal verandert zijn poreuze aard bij blootstelling aan licht
- Geometrisch verbijsterende quasikristallen gevonden in het puin van de allereerste nucleaire explosie

- Nieuw zuurvrij magneetrecyclingproces

 Hoe meters in een decametre?
Hoe meters in een decametre?  Hoeveel elektronen krijgt zwavel om de edelgas-elektronenconfiguratie te bereiken?
Hoeveel elektronen krijgt zwavel om de edelgas-elektronenconfiguratie te bereiken?  Welke moleculen bevatten een niet-polaire covalente binding?
Welke moleculen bevatten een niet-polaire covalente binding?  Oude mensen jaagden 12.000 jaar geleden op uitgestorven olifanten bij het Tagua Tagua-meer in Chili
Oude mensen jaagden 12.000 jaar geleden op uitgestorven olifanten bij het Tagua Tagua-meer in Chili  Hologramexperts kunnen nu levensechte beelden maken die in de lucht bewegen
Hologramexperts kunnen nu levensechte beelden maken die in de lucht bewegen Wetenschappers ontdekken hoe bepaalde hormonen aspecten van de wortelvertakking in planten controleren
Wetenschappers ontdekken hoe bepaalde hormonen aspecten van de wortelvertakking in planten controleren  Eenvoudige interesse zoeken
Eenvoudige interesse zoeken Juno keert terug naar Clydes Spot op Jupiter
Juno keert terug naar Clydes Spot op Jupiter
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

