
Wetenschap
Wat gebeurt er als natriumion wordt gespoten over de vlam?
Hier is hoe het werkt:
1. excitatie: De hitte van de vlam boeit de natriumionen, waardoor hun elektronen naar hogere energieniveaus springen.
2. De-excitatie: De opgewonden elektronen zijn onstabiel en keren snel terug naar hun grondtoestand. Terwijl ze dat doen, geven ze de geabsorbeerde energie vrij in de vorm van licht.
3. Specifieke golflengte: De vrijgegeven energie komt overeen met een specifieke golflengte van licht, die in het geval van natrium zich in het gele gedeelte van het zichtbare spectrum bevindt.
Praktische toepassingen:
* Vlamtests: Deze eigenschap wordt in chemie gebruikt om de aanwezigheid van natrium in een monster te identificeren.
* Streetlights: Natriumdamplampen gebruiken dit principe om een fel geel licht te produceren.
* vuurwerk: Natriumverbindingen worden in vuurwerk gebruikt om gele kleuren te maken.
Veiligheidsmaatregelen:
* Natrium is een reactief metaal en kan gevaarlijk zijn. Het is cruciaal om het met voorzichtigheid af te handelen en passende veiligheidsuitrusting te dragen.
* Probeer dit experiment niet uit te voeren zonder de juiste toezicht en veiligheidsmaatregelen.
 Verlaagd zwavelgehalte in scheepsbrandstof in verband met verhoogde maritieme opwarming van de atmosfeer
Verlaagd zwavelgehalte in scheepsbrandstof in verband met verhoogde maritieme opwarming van de atmosfeer  Hoe beïnvloedt farmaceutische vervuiling de rivieren van de wereld?
Hoe beïnvloedt farmaceutische vervuiling de rivieren van de wereld? Klimaatverandering:kinderen veroveren een plaats in de politiek, nu moeten volwassenen luisteren en handelen
Klimaatverandering:kinderen veroveren een plaats in de politiek, nu moeten volwassenen luisteren en handelen Coronavirus remt wereldwijde productie van plastic
Coronavirus remt wereldwijde productie van plastic Oost-Aziatische warmwaterbron gekoppeld aan de anomalie van de oppervlaktetemperatuur van de Atlantische Oceaan
Oost-Aziatische warmwaterbron gekoppeld aan de anomalie van de oppervlaktetemperatuur van de Atlantische Oceaan
Hoofdlijnen
- Wetenschappers ontdekken hoe bepaalde hormonen aspecten van de wortelvertakking in planten controleren
- Hoeveel chromosomen zitten er in menselijke haploïde gameten?
- Wel of niet steken? Hoe bijen verdedigingsgedrag organiseren
- Wat is de betekenis van chromosoomnummer in gameten?
- Wat is een voorbeeld van intern en extern in wetenschapsdefinities?
- Hoe mitochondriën een krachtige klap inzetten tegen levensbedreigende bacteriën
- Om te groeien en te overleven hebben cellen informatie nodig uit hun DNA-voedingsomgeving. Wanneer een cel echter te groot wordt, wat doet deze dan?
- Welke cellen produceren GEEN celwanden?
- Wat regelt de eigenschap die kinderen erven?
- Onderzoekers fabriceren bio-vriendelijke röntgendetectoren op basis van metaalvrije perovskiet-eenkristallen

- Zeewaterbacteriën bieden aanknopingspunten om melanoom te bestrijden
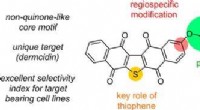
- Video:Hoe kook je een ei zonder hitte - en andere rare eierwetenschap

- De zwavelshuttle stoppen voor betere batterijen

- Onderzoekers ontwikkelen veelzijdige waterstofsensor
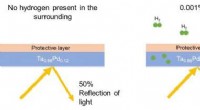
 VS klaagt Californië aan wegens netneutraliteit
VS klaagt Californië aan wegens netneutraliteit Zijn er natuurlijke nanotechnologieën?
Zijn er natuurlijke nanotechnologieën?  Nieuwe methode voor snelle synthese van natuurlijke stemmen
Nieuwe methode voor snelle synthese van natuurlijke stemmen Wat zal het volume zijn van 16,0 gram zwaveldioxidegas bij 35 C en 97 ATM?
Wat zal het volume zijn van 16,0 gram zwaveldioxidegas bij 35 C en 97 ATM?  'Sharenting'-trends:delen ouders te veel over kinderen op sociale media?
'Sharenting'-trends:delen ouders te veel over kinderen op sociale media?  Hoe seconden om te zetten in mijlen per uur
Hoe seconden om te zetten in mijlen per uur  Hoe een haai te volgen:nieuw onderzoek onthult waar, waarom en hoe haaien en wildvissen elkaar overlappen
Hoe een haai te volgen:nieuw onderzoek onthult waar, waarom en hoe haaien en wildvissen elkaar overlappen Zinken of zwemmen:mismatch tussen puin op de grond en op de zeebodem onthuld
Zinken of zwemmen:mismatch tussen puin op de grond en op de zeebodem onthuld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

