
Wetenschap
Waarom heeft het element met het laagste atoomnummer de grootste stralen in elke periode?
* Atomische structuur: Atomen bestaan uit een kern (bevattende protonen en neutronen) omgeven door elektronen in verschillende energieniveaus (elektronenschillen).
* Over een periode: Terwijl je een periode van links naar rechts beweegt, neemt het aantal protonen in de kern toe. Deze verhoogde positieve lading trekt de elektronen sterker aan en trekt ze dichter bij de kern. Dit resulteert in een kleinere atoomradius Terwijl je over een periode gaat.
* een groep neer: Terwijl je een groep naar beneden gaat, voeg je nieuwe energieniveaus (schelpen) toe aan het atoom. Deze buitenste schalen zijn verder van de kern, wat leidt tot een grotere atoomradius .
Voorbeeld:
* Periode 2: Lithium (Li) heeft het kleinste atoomnummer en de grootste atoomradius in periode 2. Terwijl u naar rechts gaat, neemt de straal af, met beryllium (BE), boor (B), koolstof (C), stikstof (N), zuurstof (O), fluor (F) en neon (NEON (NE) met geleidelijk kleinere radii.
* Periode 3: Natrium (NA) heeft de grootste atoomradius in periode 3 omdat het het kleinste atoomnummer heeft.
Samenvattend:
Het element met het laagste atoomnummer in elke periode heeft de grootste atoomradius omdat het de minste protonen in zijn kern heeft, wat leidt tot een zwakkere aantrekkingskracht op de elektronen en een grotere afstand tussen de kern en de buitenste elektronenschil.
 Welke pH-waarden worden als sterk en zwak beschouwd?
Welke pH-waarden worden als sterk en zwak beschouwd?  Directe detectie van circulerende tumorcellen in bloedmonsters
Directe detectie van circulerende tumorcellen in bloedmonsters Om autocoatings te verbeteren, nieuwe tests doen meer dan krassen op het oppervlak
Om autocoatings te verbeteren, nieuwe tests doen meer dan krassen op het oppervlak Wat is verkleuring van metaal door blootstelling aan lucht?
Wat is verkleuring van metaal door blootstelling aan lucht?  Kunnen insectenlarven helpen bij het oplossen van verkrachtingsmoordzaken?
Kunnen insectenlarven helpen bij het oplossen van verkrachtingsmoordzaken?
 Wat zijn de twee belangrijkste componenten van de atmosfeer van de aarde?
Wat zijn de twee belangrijkste componenten van de atmosfeer van de aarde?  Gezondheidsinformatie oogsten op een ongebruikelijke plek:de afvalwaterzuiveringsinstallatie
Gezondheidsinformatie oogsten op een ongebruikelijke plek:de afvalwaterzuiveringsinstallatie De oude Minoïsche uitbarsting van Thera dateren met behulp van boomringen
De oude Minoïsche uitbarsting van Thera dateren met behulp van boomringen Groenlandse ijskap bereikte 20 jaar geleden omslagpunt nieuwe studie vondsten
Groenlandse ijskap bereikte 20 jaar geleden omslagpunt nieuwe studie vondsten Oude aardverschuiving verwoest gebied ter grootte van Cincinnati
Oude aardverschuiving verwoest gebied ter grootte van Cincinnati
Hoofdlijnen
- Is het waar dat wanneer cellen naar hogere organisatieniveaus gaan in een organisme, ze moeten werken met minder verschillende soorten cellen?
- Waarom het zo goed voelt om bang te zijn
- Wat is Cleidoian Egg?
- Onderzoekers onthullen nieuwe inzichten in de controle van cellulaire steigers
- Wat zijn de twee belangrijkste afdelingen van de celcyclus?
- Waarom is streakplating zo'n essentiële procedure in de isolatie en karakterisering van bacteriën?
- Zijn homologe chromosomen gematchte DNA -eenheden die genetische informatie bevatten?
- Waarom zijn twee verschillende primers vereist voor de polymerasekettingreactie?
- Wat moet wetenschapper afleiden?
- Aardgas kan de kloof overbruggen van benzine naar elektrische voertuigen, dankzij metaal-organische raamwerken
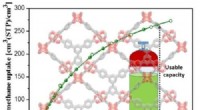
- Onderzoekers creëren aerogels met vormgeheugen met rubberachtige elasticiteit

- Onderzoekers demonstreren een fundamenteel nieuwe benadering van echografie

- Birnessietstudie biedt inzichten voor elektrochemie, energie opslag

- Een onderzoek naar katalysatoren voor het synthetiseren van polyethyleen met ultrahoog molecuulgewicht
 Wat is bobtailing wat betreft FES?
Wat is bobtailing wat betreft FES?  Hoe de overname van Activision Blizzard door Microsoft metaverse gaming naar de massamarkt zal drijven
Hoe de overname van Activision Blizzard door Microsoft metaverse gaming naar de massamarkt zal drijven Waar wordt Carborane Superacid of HCHB11Cl11 voor gebruikt?
Waar wordt Carborane Superacid of HCHB11Cl11 voor gebruikt?  Wetenschappers identificeren hotspots van kustrisico's in Latijns-Amerika en het Caribisch gebied
Wetenschappers identificeren hotspots van kustrisico's in Latijns-Amerika en het Caribisch gebied Wat gebeurt er met een atoom als het een elektron verliest?
Wat gebeurt er met een atoom als het een elektron verliest?  SpaceX Dragons laatste test:de aarde in één stuk bereiken
SpaceX Dragons laatste test:de aarde in één stuk bereiken Voorgestelde kwantum nano-MRI zou afbeeldingen kunnen genereren met een resolutie op angstrom-niveau
Voorgestelde kwantum nano-MRI zou afbeeldingen kunnen genereren met een resolutie op angstrom-niveau Welke twee factoren worden gebruikt om het klimaat in de K te classificeren?
Welke twee factoren worden gebruikt om het klimaat in de K te classificeren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

