
Wetenschap
Welke elementen zijn polair en niet -polair?
Polar vs. Nonpolar:The Basics
* polariteit gaat over de verdeling van elektronen in een molecuul.
* polaire moleculen hebben een ongelijke verdeling van elektronen, waardoor een enigszins positief uiteinde (δ+) en een enigszins negatief uiteinde ontstaat (Δ-).
* Niet -polaire moleculen hebben een gelijkmatige verdeling van elektronen, dus geen afzonderlijke positieve of negatieve uiteinden vormen.
Belangrijke factoren die de polariteit beïnvloeden
* elektronegativiteit: Dit is het vermogen van een atoom om elektronen naar zichzelf aan te trekken in een chemische binding.
* grotere verschillen in elektronegativiteit tussen atomen in een binding leiden tot een meer polaire binding.
* Vergelijkbare elektronegativiteit resulteert in een niet -polaire of enigszins polaire binding.
* Moleculaire geometrie: Zelfs als een molecuul polaire bindingen heeft, als de geometrie symmetrisch is, kunnen de polariteiten annuleren, waardoor het totale molecuul niet -polair is.
Voorbeelden van polaire en niet -polaire elementen en moleculen
elementen
* elementen zijn inherent niet -polair. Dit komt omdat ze bestaan uit slechts één type atoom, dus het elektronegativiteitsverschil in het element is nul.
moleculen
Polar:
* water (h₂o): Het zuurstofatoom heeft een hogere elektronegativiteit dan waterstof, waardoor een gebogen vorm ontstaat met een gedeeltelijke negatieve lading op de zuurstof en gedeeltelijke positieve ladingen op de hydrogenen.
* waterstofchloride (HCl): Chloor heeft een hogere elektronegativiteit dan waterstof, waardoor de binding polair is.
* ammoniak (NH₃): Stikstof is elektronegatiefer dan waterstof, waardoor een piramide -vorm ontstaat met een eenzaam paar elektronen op stikstof, wat bijdraagt aan de polariteit.
nonpolar:
* diatomee elementen (zoals n₂, o₂, cl₂): Deze moleculen hebben een gelijkmatige verdeling van elektronen als gevolg van gelijke elektronegativiteiten en symmetrische structuren.
* koolstofdioxide (co₂): Hoewel koolstofoxygenbindingen polair zijn, annuleert de lineaire vorm van het molecuul de polariteiten.
* methaan (ch₄): De tetraëdrische geometrie van methaan resulteert in een gelijkmatige verdeling van elektronendichtheid, waardoor het niet -polair is.
Belangrijke opmerking: De termen "polair" en "niet -polair" worden vaak gebruikt om bindingen in een molecuul te beschrijven. Een enkele binding binnen een molecuul kan polair zijn, maar het totale molecuul kan nog steeds niet -polair zijn vanwege de symmetrische structuur.
Laat het me weten als je nog meer vragen hebt over specifieke moleculen of meer voorbeelden wilt!
 Hoe te zoeken Squirrel Nests
Hoe te zoeken Squirrel Nests Kunstmatige intelligentie om de perceptie van burgers ten aanzien van geluidsoverlast te meten
Kunstmatige intelligentie om de perceptie van burgers ten aanzien van geluidsoverlast te meten Kwikniveaus in Hawaiiaans grootoog, geelvintonijn rijzend
Kwikniveaus in Hawaiiaans grootoog, geelvintonijn rijzend Weerspiegelt GTA5 de opmars van klimaatverandering en plasticvervuiling?
Weerspiegelt GTA5 de opmars van klimaatverandering en plasticvervuiling? Bill Nye zegt dat de VS faalt in een nationale test van wetenschappelijke geletterdheid
Bill Nye zegt dat de VS faalt in een nationale test van wetenschappelijke geletterdheid
Hoofdlijnen
- Medaka-vissen gebruiken gezichten om verschillende individuen te identificeren
- Wat is de wetenschappelijke methode gebruikt observatie en welk ander proces om vragen te beantwoorden?
- Waarom worden experimenten waarbij transplanterende soorten worden uitgevoerd die vandaag zelden worden uitgevoerd?
- Onderzoekers tonen aan dat de natuur haar meest vitale DNA behoudt door te multitasken
- Welke dieren eten tandvleesbomen?
- Meer waarnemingen van een bedreigde diersoort betekent niet altijd dat deze zich herstelt
- Hoe classificeerde Linnaeus organismen op basis van hun overeenkomsten?
- Hoe 'moleculaire machines' genactivatie op gang brengen onthuld
- Hoe is het virus als een cel?
- Adsorberend materiaal ontwikkeld uit PET-flessen voor het verwijderen van antibiotica uit water
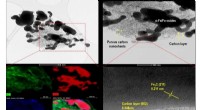
- Hoe wetenschappers infectieveroorzakende biofilms bestrijden
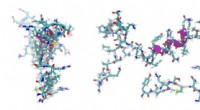
- Mechanochemische vorming van peptidebindingen achter de oorsprong van het leven
- Kunnen we grafiet maken van steenkool? Onderzoekers beginnen met het vinden van nieuwe vaste koolstof

- Kleine precipitaten maken een groot verschil bij het verminderen van de wisselwerking tussen sterkte en ductiliteit

 Cameravallen tonen de impact van recreatieve activiteiten op wilde dieren
Cameravallen tonen de impact van recreatieve activiteiten op wilde dieren  Hoeveel voet is 103 inch?
Hoeveel voet is 103 inch?  Wat kan bacillen doen onder ongunstige omstandigheden?
Wat kan bacillen doen onder ongunstige omstandigheden?  Wat wijst op de migratiepatronen van zalm?
Wat wijst op de migratiepatronen van zalm?  Wetenschappers vinden hoogste gehalte aan microplastics ooit op zeebodem
Wetenschappers vinden hoogste gehalte aan microplastics ooit op zeebodem Wetenschappers nemen vingerafdrukken van objecten en virussen op nanoschaal
Wetenschappers nemen vingerafdrukken van objecten en virussen op nanoschaal Hoe is het leven op aarde ontstaan?
Hoe is het leven op aarde ontstaan?  Spectrale beeldvorming met superresolutie om dynamische processen in realtime te bewaken
Spectrale beeldvorming met superresolutie om dynamische processen in realtime te bewaken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

