
Wetenschap
Wat is het verschil tussen een sterk zuur of basis en zwakke basis?
Sterke zuren/basen:
* volledig ioniseren In oplossing, wat betekent dat ze al hun waterstofionen (H+) of hydroxide-ionen (OH-) doneren aan de oplossing.
* Voorbeelden:
* Sterke zuren: HCl (zoutzuur), HNO3 (salpeterzuur), H2SO4 (zwavelzuur)
* Sterke bases: NaOH (natriumhydroxide), KOH (kaliumhydroxide), lioh (lithiumhydroxide)
Zwakke zuren/basen:
* gedeeltelijk ioniseren in oplossing, wat betekent dat ze alleen een fractie van hun waterstofionen of hydroxide -ionen doneren.
* bestaan in evenwicht met hun geïoniseerde en niet-geïoniseerde vormen.
* Voorbeelden:
* Zwakke zuren: CH3COOH (azijnzuur), H2CO3 (carbonzuur), HF (hydrofluorinezuur)
* Zwakke bases: NH3 (ammoniak), CH3NH2 (methylamine), NAHCO3 (natriumbicarbonaat)
Hier is een tabel die de belangrijkste verschillen samenvat:
| Feature | Sterke zuren/basen | Zwakke zuren/basen |
| --- | --- | --- |
| Ionisatie | Compleet | Gedeeltelijk |
| Evenwicht | Geen evenwicht | Bestaat in evenwicht |
| pH van oplossing | Zeer laag (zuur) of zeer hoog (basic) | Enigszins zuur of basic |
| Sterkte van ionisatie | Hoog | Laag |
Het belang van dit onderscheid:
* sterke zuren/basen zijn meer corrosief en kan ernstiger chemische brandwonden veroorzaken.
* zwakke zuren/basen zijn over het algemeen veiliger om te hanteren en worden vaak in het dagelijks leven gebruikt.
* zwakke zuren/basen Speel een belangrijke rol in biologische systemen, zoals het bufferen van de pH van de bloed.
Key Takeaway: Het verschil tussen sterke en zwakke zuren/basen ligt in hun vermogen om H+ of OH-ionen te doneren. Sterke zuren/basen doen dit volledig, terwijl zwakke zuren/basen dit alleen gedeeltelijk doen. Dit verschil beïnvloedt hun reactiviteit, veiligheid en gebruik.
 Wat is de dichtheid van 1 cm water?
Wat is de dichtheid van 1 cm water?  Wat is waterstofgas plus zuurstof en koolstofdioxide?
Wat is waterstofgas plus zuurstof en koolstofdioxide?  Welk document moet u beoordelen voordat u met een specifiek koelmiddel of chemisch werkt?
Welk document moet u beoordelen voordat u met een specifiek koelmiddel of chemisch werkt?  Hoe drie mutaties samenwerken om nieuwe SARS-CoV-2-varianten te stimuleren
Hoe drie mutaties samenwerken om nieuwe SARS-CoV-2-varianten te stimuleren  Hoe beïnvloedt koeling het volume van de stof?
Hoe beïnvloedt koeling het volume van de stof?
 De toekomst van drinkwater in Amerika
De toekomst van drinkwater in Amerika Energieagentschap:stop nieuwe investeringen in de levering van fossiele brandstoffen
Energieagentschap:stop nieuwe investeringen in de levering van fossiele brandstoffen Pre-Kaikoura-enquête vond hiaten in het bewustzijn van de tsunami van Kiwi's
Pre-Kaikoura-enquête vond hiaten in het bewustzijn van de tsunami van Kiwi's Hoe de kern van de aarde is als een cake met meerdere lagen
Hoe de kern van de aarde is als een cake met meerdere lagen NASA weegt mee in de ontwikkeling van aardolie in de Noordelijke IJszee
NASA weegt mee in de ontwikkeling van aardolie in de Noordelijke IJszee
Hoofdlijnen
- Studie brengt in kaart hoe genen de nieren instrueren om zich anders te ontwikkelen bij muizen en mensen
- Waarom zijn inunit mensen een voorbeeld van evolutie?
- Voorbeelden van de vijf thema's van de geografie
- Onderzoeker zegt dat niet elke exotische soort gecontroleerd hoeft te worden
- Zijn aquaporines betrokken bij osmose of gefaciliteerde diffusie?
- Hoe evolueerden zenuwstelsels, met hun ongelooflijke complexiteit, tussen verschillende soorten?
- Wanneer een nerveuze impuls van neuron tot spiercel reist, wat gebeurt er daarna?
- Onderzoek toont aan hoe het eiwit de ontwikkeling van fruitvliegvleugels regelt
- Zonneboerderijen een smet op het landschap? Onderzoek toont aan dat ze dieren in het wild ten goede kunnen komen
- Onderzoekers laten zien dat materialen vanzelf sterker worden wanneer ze met zeer hoge snelheid worden geraakt
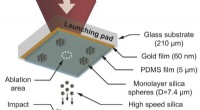
- Door bleekmiddel geïnduceerde transformatie voor vochtbestendige luchtfilters

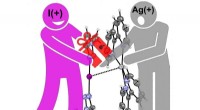
- Interactie tussen jodonium en zilverkation voor het eerst aangetoond
- Blauw-emitterende diode demonstreert beperkingen en belofte van perovskiet-halfgeleiders
- Echografie kan sterkere 3D-geprinte legeringen maken

 Is de Bondo-aap een cryptide of een speciaal aangepaste chimpansee?
Is de Bondo-aap een cryptide of een speciaal aangepaste chimpansee?  Informatie over olievlekken voor kinderen
Informatie over olievlekken voor kinderen Chi-Square Test
Chi-Square Test Hoe glanzend zijn bijna-aardse objecten?
Hoe glanzend zijn bijna-aardse objecten? NASA-satellietgegevens tonen Humbertos structuurverandering
NASA-satellietgegevens tonen Humbertos structuurverandering Cellulose-biobrandstoffen kunnen het milieu ten goede komen als ze op de juiste manier worden beheerd
Cellulose-biobrandstoffen kunnen het milieu ten goede komen als ze op de juiste manier worden beheerd Onderzoekers lossen grote uitdaging op bij massaproductie van goedkope zonnecellen
Onderzoekers lossen grote uitdaging op bij massaproductie van goedkope zonnecellen Welk effect heeft zweet dat je lichaam verlaat op de temperatuur?
Welk effect heeft zweet dat je lichaam verlaat op de temperatuur?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

