
Wetenschap
Waarom zijn PBBR4 en PBI4 onstabiel?
1. Groot formaat verschil tussen fosfor- en halogeenatomen:
* Fosfor is een relatief klein atoom in vergelijking met broom en jodium.
* Het grote grootteverschil tussen fosfor en de halogenen creëert een significante mismatch in atomaire stralen.
* Deze mismatch leidt tot zwakke bindingsinteracties en maakt de verbindingen onstabiel.
2. Sterische hindering:
* De grote broom- en jodiumatomen creëren een significante sterische hinder rond het fosforatoom.
* Deze overbevolking maakt het voor het molecuul moeilijk om een stabiele geometrie te behouden.
* De sterische afstoting verzwakt de bindingen verder en draagt bij aan instabiliteit.
3. Polariseerbaarheid van halogeenatomen:
* Bromine en jodium zijn zeer polariseerbare atomen, wat betekent dat hun elektronenwolken gemakkelijk kunnen worden vervormd.
* Deze polariseerbaarheid kan leiden tot significante interacties tussen de halogeenatomen, waardoor het molecuul mogelijk wordt ontleed.
4. Gebrek aan een stabiele oxidatietoestand:
* Fosfor is bekend dat het stabiele oxidatietoestanden van +3 en +5 vertoont.
* In pbbr 4 en PBI 4 , Phosporus bevindt zich in een formele oxidatietoestand van +4, die minder vaak voorkomt en minder stabiel is.
5. Vorming van stabielere verbindingen:
* De ontleding van PBBR 4 en PBI 4 leidt vaak tot de vorming van stabielere verbindingen, zoals fosforhalogeniden met lagere oxidatietoestanden (bijv. PBR 3 , Pi 3 ) of elementaire broom en jodium.
Samenvattend, de instabiliteit van PBBR 4 en PBI 4 komt voort uit een combinatie van factoren gerelateerd aan grootmatchismatch, sterische hindering, polariseerbaarheid en het ontbreken van een stabiele oxidatietoestand voor fosfor. Deze factoren dragen bij aan zwakke bindingsinteracties en bevorderen de vorming van stabielere verbindingen.
 Wat is de golflengte van koper-II-sulfaat?
Wat is de golflengte van koper-II-sulfaat?  Een snelle, milieuvriendelijke manier om vliegtuigen ijsvrij te maken
Een snelle, milieuvriendelijke manier om vliegtuigen ijsvrij te maken Ultrakleine, vormveranderende GEMS bieden een eenvoudiger en goedkopere manier om MRI-beeldvorming te verbeteren
Ultrakleine, vormveranderende GEMS bieden een eenvoudiger en goedkopere manier om MRI-beeldvorming te verbeteren  Regulering van de atomaire Fe-Rh-plaatsafstand voor een efficiënte zuurstofreductiereactie
Regulering van de atomaire Fe-Rh-plaatsafstand voor een efficiënte zuurstofreductiereactie  Welke term beschrijft een stof die kan worden opgelost?
Welke term beschrijft een stof die kan worden opgelost?
 Voorbeelden van planten die in water leven
Voorbeelden van planten die in water leven  NASA betrapt vorming van vijfde Atlantische depressie
NASA betrapt vorming van vijfde Atlantische depressie Eerlijkere financiering zou het netto nulpunt voor Afrika met een decennium kunnen versnellen
Eerlijkere financiering zou het netto nulpunt voor Afrika met een decennium kunnen versnellen De manier waarop planten koolstof gebruiken, beïnvloedt hun reactie op klimaatverandering
De manier waarop planten koolstof gebruiken, beïnvloedt hun reactie op klimaatverandering  Een harde regen in Australië met klimaatverandering
Een harde regen in Australië met klimaatverandering
Hoofdlijnen
- De geheimen van het vergroenen van citrusvruchten ontsluiten:het cultiveren van Candidatus Liberibacter asiaticus
- Wat zijn de drie soorten colloïdale systemen?
- Zijn ribosomen grote moleculaire aggregaten van eiwitten en RNA?
- Wat is de rol van waterstof in levende organismen?
- Onderzoekers ontdekken hoe cellen bewegen terwijl ze adhesie vermijden
- Wanneer dragen de mannelijke en vrouwelijke gamete elk DNA -materiaal bij?
- Waarom was frenologie een rage in de Victoriaanse tijd?
- Onderzoekers reconstrueren het genoom van uitgestorven soorten loopvogels die ooit op de eilanden van Nieuw-Zeeland rondzwierven
- Sympatrische of micro-allopatrische soortvorming in gletsjermeren? Genomische eilanden ondersteunen geen van beide
- Aceton plus licht creëert een groen additief voor vliegtuigbrandstof

- Een nieuwe strategie om 2-D anorganische materialen te synthetiseren die in condensatoren worden gebruikt, batterijen, en composieten
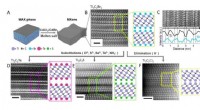
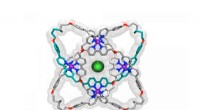
- Moleculaire knoop wint record voor 's werelds strakste
- Zonlicht kan worden gebruikt om verontreinigende stoffen in water uit te roeien

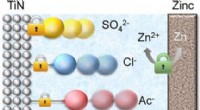
- Zink-ion hybride condensatoren met ideale anionen in de elektrolyt vertonen extra lange prestaties
 Cynisme, autonomie en werkplezier:bewijs uit het lerarenberoep
Cynisme, autonomie en werkplezier:bewijs uit het lerarenberoep Zwaartekrachtgolven opnieuw gevonden:zo konden ze de geheimen van het universum fluisteren
Zwaartekrachtgolven opnieuw gevonden:zo konden ze de geheimen van het universum fluisteren  Dieet in de haven:leven en sterven in de haven van het oude Rome
Dieet in de haven:leven en sterven in de haven van het oude Rome Hoe de nederige houtsnippers wereldwijd water opruimen
Hoe de nederige houtsnippers wereldwijd water opruimen Wat gebeurt er als je zink in zoutzuur doet?
Wat gebeurt er als je zink in zoutzuur doet?  Loodsaneringsinspanningen zijn veelbelovend voor veilig drinkwater op openbare scholen in New York
Loodsaneringsinspanningen zijn veelbelovend voor veilig drinkwater op openbare scholen in New York  Wat is de relatie tussen Pangea en continenten?
Wat is de relatie tussen Pangea en continenten?  'S Werelds grootste röntgenlaser opent enorme onderzoeksvergezichten
'S Werelds grootste röntgenlaser opent enorme onderzoeksvergezichten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

