
Wetenschap
Waarom worden alkali -metalen bereid door elektrolyse van hun gefuseerde chloriden?
1. Hoge reactiviteit: Alkali -metalen zijn zeer reactief en kunnen niet worden verkregen door conventionele methoden voor chemische reductie. Ze reageren gemakkelijk met water, zuurstof en andere elementen.
2. Elektrolyse van gefuseerde chloriden: De elektrolyse van gefuseerde chloriden biedt een geschikte omgeving voor de reductie van alkali -metaalionen. Het gesmolten zout werkt als zowel de elektrolyt als het oplosmiddel.
3. Hoog smeltpunt: Alkalimetaalchloriden hebben hoge smeltpunten, waardoor hoge temperaturen moeten smelten. De hoge temperaturen zorgen ervoor dat de ionen mobiel zijn en kunnen deelnemen aan het elektrolytische proces.
4. Elektrolytisch proces: Tijdens elektrolyse treden de volgende reacties op:
* bij de kathode: Alkali -metaalionen (M+) krijgen elektronen en worden gereduceerd tot alkali -metalen (M).
`` `
M + + E- → M
`` `
* bij de anode: Chloride-ionen (Cl-) verliezen elektronen en worden geoxideerd om chloorgas te vormen (CL2).
`` `
2CL- → Cl2 + 2e-
`` `
5. Scheiding van producten: Het gesmolten alkalimetaal is minder dicht dan het gesmolten chloride en zweeft naar de bovenkant, waardoor een gemakkelijke scheiding mogelijk is. Het chloorgas wordt ook gemakkelijk verzameld.
6. Kosteneffectiviteit: De elektrolyse van gefuseerde chloriden is een relatief kosteneffectieve methode voor het produceren van alkali-metalen op industriële schaal.
Voorbeeld:
De bereiding van natriummetaal door de elektrolyse van gesmolten natriumchloride (NaCl) is een bekend voorbeeld.
Algemene reactie:
`` `
2Nacl (L) → 2NA (L) + CL2 (G)
`` `
Samenvattend: De elektrolyse van gefuseerde chloriden biedt een geschikte omgeving voor de vermindering van alkali -metalen, het overwinnen van hun hoge reactiviteit en het mogelijk maken van hun efficiënte productie.
 Eerste openbare wereldwijde database van fossiele brandstoffen gelanceerd
Eerste openbare wereldwijde database van fossiele brandstoffen gelanceerd Onderzoek toont aan dat de perceptie van orkaanrisico's afneemt nadat stormen toeslaan
Onderzoek toont aan dat de perceptie van orkaanrisico's afneemt nadat stormen toeslaan  De wederopbouw van de aardbeving in Nepal zal niet slagen totdat de kwetsbaarheid van de overlevenden is aangepakt
De wederopbouw van de aardbeving in Nepal zal niet slagen totdat de kwetsbaarheid van de overlevenden is aangepakt 10 Oorzaken van luchtvervuiling
10 Oorzaken van luchtvervuiling De beste manier om zich te ontdoen van Armadillos
De beste manier om zich te ontdoen van Armadillos
Hoofdlijnen
- Een poging om veelvraat terug te halen naar Californië mislukt vanwege begrotingsproblemen
- Wat is de wetenschappelijke naam van bamboe?
- Heeft een bladcel chloroplast?
- Welke invloed heeft big data op sportanalyses?
- Factoren die celdeling beïnvloeden
- Onderzoek verklaart waarom bepaalde immuuntherapieën niet altijd werken zoals voorspeld
- Wat is de eigenaardigheid van structuur -DNA?
- Uit het laatste onderzoek blijkt dat eksterganzen de verleiding van NT-mangogekte weerstaan
- Waarom vereist evolutie diversiteit binnen een soort?
- Waterbehandeling:hormonen verwijderen met zonlicht

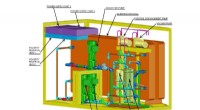
- Nrl ontvangt patent voor koolstofafvangapparaat - een belangrijke stap in de productie van synthetische brandstof uit zeewater
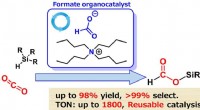
- Een metaalvrije, duurzame benadering van CO2-reductie
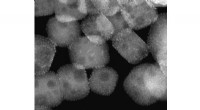
- Plastic afval omzetten in smeeroliën
- Beton met verbeterd slagvastheid voor verdedigingsconstructies

 Ost-geologen denken dat de beweging van aardplaten wordt veroorzaakt door?
Ost-geologen denken dat de beweging van aardplaten wordt veroorzaakt door?  Waar begint de nucleolus uiteen te vallen?
Waar begint de nucleolus uiteen te vallen?  Facebook in nieuwe controverse over ontkenning Holocaust
Facebook in nieuwe controverse over ontkenning Holocaust Enorme hausse hoopt plastic afval in de Stille Oceaan te verzamelen
Enorme hausse hoopt plastic afval in de Stille Oceaan te verzamelen Nieuwe inzichten in hoe KLF4 genexpressie beïnvloedt
Nieuwe inzichten in hoe KLF4 genexpressie beïnvloedt  Welke elektronen zijn de volant van het atoom?
Welke elektronen zijn de volant van het atoom?  Wat is het pH-niveau van zuiveringszout?
Wat is het pH-niveau van zuiveringszout?  Hoe kan het toevoegen van kalk aan zeewater de CO2-uitstoot in de atmosfeer verminderen?
Hoe kan het toevoegen van kalk aan zeewater de CO2-uitstoot in de atmosfeer verminderen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

