
Wetenschap
Wat veroorzaakt volume contractie tussen ethanol en water?
* waterstofbinding: Ethanol en water vormen beide waterstofbindingen. Watermoleculen zijn zeer polair met sterke waterstofbinding daartussen. Ethanol vormt ook waterstofbindingen, hoewel zwakker dan water. Wanneer ze worden gemengd, vormen deze waterstofbindingen zich ook tussen ethanol- en watermoleculen, wat leidt tot een meer georganiseerde en compacte structuur.
* van der Waals krachten: Naast waterstofbinding dragen zwakkere Van der Waals -krachten ook bij aan de aantrekkingskracht tussen ethanol en watermoleculen. Deze krachten helpen de moleculen dichter bij elkaar te houden.
Hoe het volume beïnvloedt:
De vorming van deze sterke intermoleculaire interacties resulteert in een nauwere verpakking van de moleculen. Dit betekent dat het volume bezet door het mengsel minder is dan de som van de volumes van de afzonderlijke componenten.
Sleutelpunten:
* Niet-ideaal mengen: Ethanol en water vertonen niet-ideaal mengen . Dit betekent dat hun volumes niet alleen maar kloppen.
* Maximale samentrekking: De maximale volumecontractie treedt op wanneer het mengsel ongeveer 40% ethanol per volume is.
* Temperatuurafhankelijkheid: De mate van volume -contractie is afhankelijk van de temperatuur.
Andere factoren:
* Moleculaire grootte: Ethanolmoleculen zijn groter dan watermoleculen. Dit verschil in grootte draagt ook bij aan de nadere verpakking.
* Hydrofobe effecten: Ethanol heeft een niet-polaire koolwaterstofketen, terwijl water polair is. Dit creëert een hydrofoob effect, waarbij de ethanolmoleculen proberen het contact met water te minimaliseren, wat leidt tot een meer compacte structuur.
Samenvattend: De volumecontractie waargenomen bij het mengen van ethanol en water is een gevolg van de sterke intermoleculaire interacties tussen de twee moleculen, wat leidt tot een meer georganiseerde en compacte opstelling. Dit fenomeen is het gevolg van niet-ideale menging en wordt beïnvloed door factoren zoals waterstofbinding, van der Waals-krachten, moleculaire grootte en hydrofobe effecten.
 Van zee tot stijgende zee - klimaatverandering in Amerika
Van zee tot stijgende zee - klimaatverandering in Amerika We moeten ons snel aanpassen aan erosie en stijgende zeespiegels om kustrisico's te beheersen
We moeten ons snel aanpassen aan erosie en stijgende zeespiegels om kustrisico's te beheersen Zoet water gevonden in de Noorse Zee
Zoet water gevonden in de Noorse Zee Orkanen kunnen heviger worden - hebben we een hele nieuwe categorie nodig om ze te beschrijven?
Orkanen kunnen heviger worden - hebben we een hele nieuwe categorie nodig om ze te beschrijven? Zijn de belangrijkste factoren die een temperatuur beïnvloeden, de heersende wind en bergen?
Zijn de belangrijkste factoren die een temperatuur beïnvloeden, de heersende wind en bergen?
Hoofdlijnen
- Hoe de van kleur veranderende hogfish met zijn huid 'ziet'
- Nieuwe inzichten in hoe de modellering van de stikstof-biomassarelaties in gewassen voor tarwestikstofbeheer kan worden verbeterd
- Alles in de familie:gerichte genomische vergelijkingen
- Angiospermen: definitie, levenscyclus, soorten en voorbeelden
- Hoe zijn organismen in een ecosysteem afhankelijk van detritivoren?
- Verschillen tussen Protozoa en Protisten
- Welk belang is de bijdrage van de microscoop in de wandcelwand?
- Welke cel kan een benige matrix opbouwen?
- Hoe classificeren we micro -organismen?
- Levensbouwstenen waargenomen in een ruimteachtige omgeving
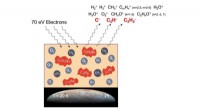
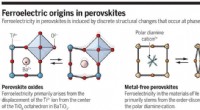
- Een manier om tegen lage kosten schonere metaalvrije perovskieten te maken
- De krachten van elektrochemie en stromingstechnologie samenbrengen

- Nieuw onderzoek laat zien hoe geclusterde deeltjes de elasticiteit van sommige gels bepalen

- Materiaal gemaakt van een enkel molecuul vormt zichzelf tot een rooster dat zichzelf kan genezen, gassen opslaan
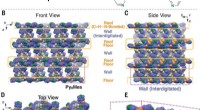
 Hoe menselijke cellen de start van DNA-replicatie coördineren
Hoe menselijke cellen de start van DNA-replicatie coördineren  Hoe de kaken van het leven werken
Hoe de kaken van het leven werken  Hoe preprints de wetenschapscommunicatie tijdens de pandemie versnelden
Hoe preprints de wetenschapscommunicatie tijdens de pandemie versnelden Waarom verwijdert het proces van koolstof uit de Atmoshere?
Waarom verwijdert het proces van koolstof uit de Atmoshere?  Hulpmiddelen voor gezichtsherkenning verbeteren met generatieve gezichtsaanvulling
Hulpmiddelen voor gezichtsherkenning verbeteren met generatieve gezichtsaanvulling Wetenschappers voorspellen dramatische toename van overstromingen, droogte in Californië
Wetenschappers voorspellen dramatische toename van overstromingen, droogte in Californië Gesynchroniseerde telescoopdans stelt grenzen aan mysterieuze flitsen in de lucht
Gesynchroniseerde telescoopdans stelt grenzen aan mysterieuze flitsen in de lucht Japanse onderzoekers maken een krabschaal transparant
Japanse onderzoekers maken een krabschaal transparant
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

