
Wetenschap
Hoe worden gehydrateerde stoffen meestal verkregen?
1. Kristallisatie van oplossing:
* Dit is de meest voorkomende methode. Een oplossing die de gewenste stof bevat, wordt bereid en vervolgens toegestaan om te koelen of te verdampen. Naarmate het oplosmiddel verdampt of de temperatuur afneemt, neemt de oplosbaarheid van de stof af, wat leidt tot de vorming van kristallen.
* Voorbeeld: Als een oplossing van kopersulfaat mag verdampen, zullen blauwe kristallen van kopersulfaat pentahydraat (cuso₄ · 5h₂o) vormen.
2. Reactie in waterige oplossing:
* Sommige reacties in waterige oplossingen produceren rechtstreeks gehydrateerde verbindingen. Dit gebeurt wanneer de reagerende soorten een sterke affiniteit hebben voor watermoleculen.
* Voorbeeld: De reactie van watervrij kobaltchloride (cocl₂) met water resulteert in de vorming van roze gehydrateerde kobaltchloride (cocl₂ · 6h₂o).
3. Directe hydratatie:
* Sommige watervrije verbindingen kunnen water rechtstreeks uit de atmosfeer absorberen. Dit proces staat bekend als deliquescence .
* Voorbeeld: Watervrij calciumchloride (CaCl₂) is een sterke droogmiddel (droogmiddel) omdat het gemakkelijk water uit de lucht absorbeert om gehydrateerd calciumchloride (CACL₂ · 2H₂O) te vormen.
4. Chemische reacties met water:
* Sommige stoffen kunnen chemisch reageren met water om gehydrateerde producten te vormen.
* Voorbeeld: Wanneer calciumoxide (CaO) reageert met water, vormt het calciumhydroxide (Ca (OH) ₂), die vaak wordt gevonden in de gehydrateerde vorm (Ca (OH) ₂ · H₂o).
5. Hydratatie van mineralen:
* Sommige mineralen worden van nature aangetroffen in gehydrateerde vormen. Deze gehydrateerde vormen worden meestal gevormd over geologische tijdschalen door interactie met water.
* Voorbeeld: Gips (CASO₄ · 2H₂O) is een natuurlijk voorkomend gehydrateerd mineraal.
Het is belangrijk op te merken dat de specifieke methode die wordt gebruikt om een gehydrateerde stof te verkrijgen, afhankelijk is van de specifieke verbinding en de eigenschappen ervan.
Hoofdlijnen
- Onderzoekers bestuderen hoe genetische stoornissen zich ontwikkelen – in een petrischaaltje (met video)
- Is de beste definitie van een hypothese?
- Waarom we niet meer verliefd moeten worden op schilferige witte vis
- Hoe u kunt gedijen als buitenlandse concurrenten uw markt betreden
- Hoe zal zalm overleven in een overstroomde toekomst?
- Hoe maak je een 3-D DNA-model voor High School Biology
- Uit onderzoek blijkt dat ongewervelde dieren een cruciale rol spelen als eco-beheerders in de mondiale afbraak van bosafval
- Waarom zou het schadelijker zijn om een mutatie in reproductieve cel te laten plaatsvinden dan lichaamscel?
- Hoe wordt het protoplasma in de kern genoemd?
- Cellen stoppen met delen als dit gen in een hogere versnelling komt, studie vondsten
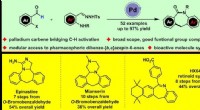
- Modulaire benadering van dibenzo-gefuseerde ε-lactams door middel van carbeen overbruggende CH-activering
- Kubusvormige ijzer-zwavelclusters ondersteunen meervoudige binding tussen ijzer en stikstof

- Naar aanpasbaar hout, gekweekt in een laboratorium
- Krachtigste en mildste reagentia verkregen op basis van milieuvriendelijk jodium

 RFK Jr.s antivaccinatiegroep begon Instagram, Facebook
RFK Jr.s antivaccinatiegroep begon Instagram, Facebook Nanosensoren kunnen de gezondheid in realtime volgen
Nanosensoren kunnen de gezondheid in realtime volgen Wat is interdisciplinaire natuurwetenschappen?
Wat is interdisciplinaire natuurwetenschappen?  Elektronencryomicroscopie:goedkope technologie gebruiken om afbeeldingen met een hoge resolutie te maken
Elektronencryomicroscopie:goedkope technologie gebruiken om afbeeldingen met een hoge resolutie te maken Welke planeet staat bekend om zijn topachtige beweging?
Welke planeet staat bekend om zijn topachtige beweging?  Je kunt de menselijke natuur niet karakteriseren als studies 85 procent van de mensen op aarde over het hoofd zien
Je kunt de menselijke natuur niet karakteriseren als studies 85 procent van de mensen op aarde over het hoofd zien Zweeds onderzoek vergroot de levensduur van oplaadbare NiMH-batterijen
Zweeds onderzoek vergroot de levensduur van oplaadbare NiMH-batterijen Onderzoek naar oceaanverzuring pleit sterk voor beperking van klimaatverandering
Onderzoek naar oceaanverzuring pleit sterk voor beperking van klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


