
Wetenschap
Wat is speciaal aan de alkali en alkalische metalen?
Alkali -metalen (groep 1):
* Eén valentie -elektron: Ze hebben een enkel elektron in hun buitenste schaal, waardoor ze zeer reactief zijn.
* Lage ionisatie -energie: Het is gemakkelijk om dit elektron te verwijderen, waardoor ze gemakkelijk kationen vormen (+1 lading).
* zeer reactief met water: Ze reageren gewelddadig met water, geven waterstofgas vrij en vormen hydroxiden.
* zacht en zilver: Ze zijn zacht genoeg om met een mes te worden gesneden en een zilverwit uiterlijk te hebben.
* Goede geleiders van warmte en elektriciteit: Hun vrije valentie -elektron zorgt voor een efficiënte geleiding.
* Laag smelt- en kookpunten: Hun zwakke metalen bindingen resulteren in lagere smelt- en kookpunten in vergelijking met andere metalen.
Alkalische aardmetalen (groep 2):
* Twee valentie -elektronen: Ze hebben twee elektronen in hun buitenste schaal, waardoor ze minder reactief zijn dan alkali -metalen, maar nog steeds behoorlijk reactief.
* Lagere ionisatie -energie dan andere groepen: Ze verliezen gemakkelijk hun twee valentie -elektronen om kationen te vormen (+2 lading).
* reactief met water, maar minder dan alkali metalen: Ze reageren met water om hydroxiden en waterstofgas te vormen, maar de reactie is minder krachtig.
* sterk en hard: Ze zijn moeilijker dan alkali -metalen en hebben een hoger smeltpunt.
* Goede geleiders van warmte en elektriciteit: Ze vertonen een goede geleidbaarheid vanwege hun vrije valentie -elektronen.
Belangrijke verschillen tussen alkali en alkalische aardmetalen:
* Reactiviteit: Alkali -metalen zijn reactiever dan alkalische aardmetalen.
* Aantal valentie -elektronen: Alkali -metalen hebben één valentie -elektron, terwijl alkalische aardmetalen er twee hebben.
* lading van ionen: Alkali -metalen vormen +1 kationen, terwijl alkalische aardmetalen +2 kationen vormen.
Toepassingen:
* Natrium en kalium: Gebruikt in verschillende industrieën, waaronder meststoffen, batterijen en verlichting.
* lithium: Gebruikt in batterijen voor elektrische voertuigen en elektronica.
* calcium: Gebruikt in cement, constructie en als voedingssupplement.
* magnesium: Gebruikt in legeringen, vuurwerk en als een reductiemiddel.
Samenvatting:
De alkali- en alkalische aardmetalen zijn fascinerende elementen met unieke eigenschappen vanwege hun elektronenconfiguraties. Hun reactiviteit, zachtheid en geleidbaarheid maken ze van vitaal belang voor veel toepassingen in de moderne samenleving.
 NASA analyseert orkaandelta's waterdampconcentratie
NASA analyseert orkaandelta's waterdampconcentratie Innovatieve technologieën voor een duurzame zuivelindustrie
Innovatieve technologieën voor een duurzame zuivelindustrie Onderzoekers brengen gevoeligheid voor door de mens veroorzaakte aardbevingen in kaart
Onderzoekers brengen gevoeligheid voor door de mens veroorzaakte aardbevingen in kaart Aardbevingen verplaatsen zich naar het noordoosten in het Midland Basin van Texas, ontdekken wetenschappers
Aardbevingen verplaatsen zich naar het noordoosten in het Midland Basin van Texas, ontdekken wetenschappers  Fotosynthese in pijnbomen
Fotosynthese in pijnbomen
Hoofdlijnen
- Wat is het doel van een analanine -aminotransferasetest?
- Hoe push-pull begeleidende gewassen helpen bij het beheersen van de verwoestende herfstplaag van legerwormen
- Wat brengt reukreceptoren naar het celoppervlak:'Postcodes' voor geursensoren geïdentificeerd
- Waarom koningsbavianenspinnengif zo pijnlijk is
- Vergelijking van vier methoden voor de droogefficiëntie en fysisch-chemische eigenschappen van kippenvlees
- Wat vertellen de DNA -instructies die cel moeten maken?
- Vliegenjager heeft 30 nieuwe soorten beschreven
- Welke invloed heeft warmte op cellen of organismen?
- Waarom bevat een spiercel meer mitochondriën dan andere type cellen?
- Onderzoekers tonen rol voor cyanide bij ontstaan van leven

- Een moleculaire snaartelefoon aan het werk
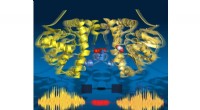
- Verder gaan dan de moleculen van Moeder Natuur om zich op radioactieve metalen te richten
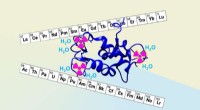
- Actief leren versnelt het ontdekken van redox-flow-batterijen

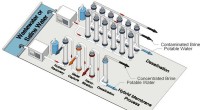
- Membraan kan afvalwater beter behandelen, waardevolle bronnen terugwinnen
 Misplaatst vertrouwen:wanneer vertrouwen in de wetenschap pseudowetenschap bevordert
Misplaatst vertrouwen:wanneer vertrouwen in de wetenschap pseudowetenschap bevordert Het is filamentair:hoe sterrenstelsels evolueren in het kosmische web
Het is filamentair:hoe sterrenstelsels evolueren in het kosmische web  Voorbeelden van natuurlijke selectie in diersoorten
Voorbeelden van natuurlijke selectie in diersoorten Onderzoekers demonstreren een methode die de wrijving tussen twee oppervlakken op macroscopische schaal tot bijna nul reduceert
Onderzoekers demonstreren een methode die de wrijving tussen twee oppervlakken op macroscopische schaal tot bijna nul reduceert Wat is de wetenschappelijke naam van Mulberry?
Wat is de wetenschappelijke naam van Mulberry?  Nieuwe getjilpte pulsen tarten conventionele wijsheid
Nieuwe getjilpte pulsen tarten conventionele wijsheid Simulatie laat zien hoe transporteiwitten hun werk doen in cellen
Simulatie laat zien hoe transporteiwitten hun werk doen in cellen  Onderzoek toont aan dat gletsjerkrimp een groene transitie veroorzaakt
Onderzoek toont aan dat gletsjerkrimp een groene transitie veroorzaakt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

